ПЕРШИЙ ЗАКОН ТЕРМОДИНАМІКИ.

Енергія в природі не виникає з нічого й нікуди не зникає, вона лише переходить з однієї форми в іншу. Цей фундаментальний закон природи набув логічної форми першого закону термодинаміки: зміна внутрішньої енергії системи у разі переходу з одного стану в інший дорівнює сумі роботи зовнішніх сил і кількості теплоти, переданої системі:
| ΔU = A + Q |
Перший закон термодинаміки записують часто в іншому вигляді, оскільки на практиці основний інтерес являє не робота А зовнішніх сил, здійснена над газом, а робота Аr, здійснена газом над зовнішнімитілами. Очевидно, Аr = -А. Крім того, шуканою величиною часто і є кількість теплоти Q. Якщо газ сам здійснює роботу внаслідок теплопередачі, то перший закон термодинаміки має вигляд: кількість теплоти, передана системі, витрачається на зміну внутрішньої енергії й здійснення системою роботи над зовнішніми тілами:
| Q = ΔU + Ar |
Необхідно зазначити, що величини, які входять у ці формули, можуть мати як знак «+», так і «—». Наприклад, (Q > 0, якщо система добуває енергію шляхом теплообміну; Q < О , якщо система віддає енергію цим же
способом. Знак роботи А (або Аr.) залежить від знака ΔU .
В рамках молекулярно-кінетичної теорії внутрішня енергія одноатомного ідеального газу визначається формулою
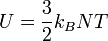 ,
,
де 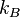 — стала Больцмана. Вона є середньою кінетичною енергією атома, помноженою на кількість атомів[2].
— стала Больцмана. Вона є середньою кінетичною енергією атома, помноженою на кількість атомів[2].
Ста́ла Бо́льцмана ( 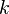 або
або 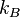 ) — фізична стала, що визначає зв'язок між температурою та енергією. Названа на честь австрійського фізика Людвіга Больцмана, який зробив великий вклад в статистичну фізику, у якій ця стала займає ключову позицію. Її експериментальне значення в системі СІ дорівнює[2]. k= 1.3806488(13)×10−23 Дж·K−1
) — фізична стала, що визначає зв'язок між температурою та енергією. Названа на честь австрійського фізика Людвіга Больцмана, який зробив великий вклад в статистичну фізику, у якій ця стала займає ключову позицію. Її експериментальне значення в системі СІ дорівнює[2]. k= 1.3806488(13)×10−23 Дж·K−1
Для одного моля газу
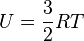 ,
,
де R — газова стала. 8.31 Дж/моль*К.
Дата добавления: 2021-06-28; просмотров: 454;











