Особенности химического состава живых организмов. Виды взаимодействий.
Основы живого организма составляют макромолекулы ,к которым относятся белки и нуклеиновая кислота .Размер молекул и их строение обуславливают сложное сочетание статистических и динамических закономерностей в их поведении. Т.о. тепловое движение атомов и атомных групп в полимерных молекулах, повороты и вращения их относительно отдельных связей приводит повышению числа степенной свободы макромолекул ,поэтому каждую молекулу можно рассматривать статистическую систему элементов .С другой стороны макромолекула имеет определенное число стационарных динамических состояний ,которые возникают за счет ближнего и дальнего порядка взаимодействующих элементов. Своеобразие биологических молекул заключается в сочетании статистических и динамических закономерностей. Все процессы происходящие с макромолекулами сопровождаются превращением энергии из одного состояния в другое. Внутри молекул происходит миграция элементов ,либо переход их в возбужденное состояния. В основе функционирования живых организмов лежат ЭКВ, которое проявляется на молекулярном уровне. Изменение формы молекул и состояния биополимеров сопровождает большинство процессов клеточного метаболизма и является отражением внутри молекулярной перестройки атомов или атомных групп. Основной задачей М.Б. является изучение природы и механизмов взаимодействия электронных и конформационных переходов, составляющих основу функционирования живых систем.Все взаимодействия между атомами макромолекулами можно разделить на 2 части:
1. Взаимодействия ближнего порядка возникших между атомами соседних звеньев полимерной цепи;
2. Дальнее взаимодействие или объектные эффекты возникающие в результате случайного сближения атомных групп при сгибании полимерной цепи.
Наличие взаимодействия только ближнего порядка приводит к возникновению клубка, не имеющего внутренней структуры. Наличие объемных взаимодействии приводит к возникновению глобул, т.е.сложных упакованных образовании с постоянной концентрацией звеньев внутри глобулы. Процесс обратного перехода от глобулы к клубку происходит при увеличении температуры и соответствует фазовому переходу второго рода. Этот процесс называется денатурацией белка. Первичная структура полимерной цепи определяется химическими или валентными взаимодействиями внутри молекул и устанавливает последовательность и состав цепи молекулы. Вторичная структура макромолекул определяется объемными взаимодействиями. Устойчивая белковая структура возникает при наличии минимальной энергии взаимодействия и является действия различных по физической природе сил. Между составляющими элементами белковых молекул существуют несколько различных по природе сил:
1. Взаимодействие Вандер-Вальса – имеет электромагнитную природу не связанную с взаимодействию между диполями принадлежащими соседним молекулам. Наиболее распространено дискретное взаимодействие, которое возникает между не полярными молекулами т.е. не имеющие собственных дипольных моментов. Природа дискретного взаимодействия имеет квантовый характер и возникает за счет мгновенного изменения плотности электрических облаков, приводящих к появлению мгновенных диполей. Энергия взаимодействия Вандер-Вальса быстро убывает с ростом между молекулами:
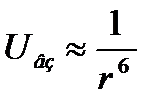
К.т. внутри белковых молекул существует электростатическое взаимодействие для полярных молекул. В общем случае с учетом сил отталкивания энергия взаимодействие имеет вид:
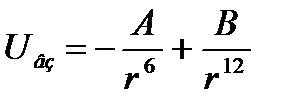
На ряду с силами Вандер-Вальса большая роль в стабилизации биологических структур играет водородные связи , между молекулами водорода входящие в пептидные группы. Сложная структура полимерной цепи создает дополнительные виды энергии связанные с внутренним вращением и поворотов звеньев цепи других относительно других. Энергия такого типа связана с изменением расстояния и взаимного положения атомных групп, составляющие белковые молекулы. Поворот пептидных групп, составляющие происходит относительно одиночной связи. При близком расположении валентно не связанные атомы отталкиваются и возникающий потенциал создает стационарное положение атомных групп друг относительно друга. Энергия вращения групп вокруг единичных связей даст основной вклад в обратную комформационную энергию полимерной цепи. К макромолекулам относятся жиры, углеводы (сахор), белки. Наиболее разнообразными являются белковые молекулы. Белковые молекулы выполняют различные функции, в зависимости от их строения и формы. Мембранные белки, в основном, представленны в виде клубков и лишь 30% в виде спиральных образований. Мембранные белки выполняют различные функции: ферментотивные, транспортные, рецепторные, каналообразные, воротные, структурные. Различные типы белковых структур состовляют белковую инрархию, котороя отрожает стадии сворачивания белка и первичной полипептидной цепи. На первичной стадии сворачивания белковой молекулы образуются α – спирали или β – пластины.
Дальнейшее сворачивание молекулы белка происходит через образования структурных сегментов, элементарных комплексов, доменов из которых и состоит глобола.
1) Последовательность аминокислот
2) Структурные сегменты
3) Домены
4) Глобулы
Структуру, обладающую необходимыми динамическими свойствами можно создать при условии выполнения нескольких принципов:
1. Для возникновения структуры необходимо что бы длинны межатомных связей и валентной структуры во всех пептидных группах были одинаковыми;
2. Полипептидная цепь должна быть насыщена водородными связями.
3. Комформационное состояние всех звеньев должны быть эквивалентны.
При выполнении этих принципов возможно образование α-спирали из двух полипептидных цепей, должна иметь следующие параметры: высота витка 0,54нм, число аминокислотных оснований в одном витке 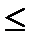 3,6. Отдельные ветки спирали связанные между собой водородными связями. β-структура представляет с собой складчатое образование, включение несколько параллельных цепей, связанных между собой водородными связями. Согласно классификации β и α структуры принадлежит вторичной структуре белка. К вторичной структуре относятся и наборы взаимодействующих между собой регуляторных комформоционных групп, состоящих из α- спиралей β-структур. Участки молекул стабилизируются в результате действие водородных связей, а так же гидрофобных воздействий между участками цепи. Установлено сопоставление между вторичной структурой белка и его аминокислотной последовательностью. На основе этих сопоставлений были сформулированы начальные принципы строение белка и правило сворачивания пептидной цепи во вторичную третичную структуру. Общая топография белковой глобулы определяется тем, что полярные группы расположены в основном на поверхности глобулы, а не полярные – внутри и образуют гидрофобное ядро. На поверхности основных элементов вторичной структуре α -спирали и β- пластины находятся целые гидрофобные области, внутримолекулярные водородные связи между пептидными границами максимально насыщены и стабилизируют глобулу. Различные типы белковых структур составляют структурную иерархию, которая отражает и последовательность стадий сворачивания от первичной структуры до глобулы. На самых ранних стадиях сворачивания в развёрнутой цепи образуются α и β участки вторичной структуры за счёт локальных взаимодействий с другими участками цепи с возникновением комплексов и доменов. Самозборка структуры белка носит направленный кооперативный характер она протекает через определённое чило промежулочных стадий, а не за счёт переборов всех возможных вариантов укладки до достижения минимального по энергетическому состоянию. Для статистической укладки глобулы потребовалось бы времени несоизмерно больше, чем реальное сворачивание глобулы. Выгодные низкоэнергетическое состояние появляются сразу на ранних этапах сворачивания 2-3 кислотных остатков. При этом среднее и дальнее взаимодействие не разрушают этих области, а лишь их стабилизируют. Т.е. вместо того, что бы пытатся сразу найти минимальную по энергетической конфигурации всей цепи, Находят в начале низкое энергетическое состояние дипептидов. Низко энергетические формы трипиктидов представляет с собой комбинации низкоэнергетических форм смежных дипептидов, сохранением низкоэнергетических форм. Известно, что белки выполняющие одинаковые функции в различных организмов могут отличатся по своей первичной последовательности. Однако, третичная структура одинакова. Способностью формировать α и β структуры с непременными гидрофобными поверхностями, обладают лишь некоторые аминокислотные остатки, т.е. для получения плотной упаковки белка нет необходимости абсолютно однозначно задавать его первичную последовательность, т.к. функциональные свойства белка определяются сравнительно не большими числами активных групп. В активном центре белка имеются 5-6 остатков, которые нельзя заменить без нарушения функциональных свойств, поэтому колебания не меняющих остатков в активном центре производятся совершенно однозначно при обязательном сохранении линии общих топографических черт глобулы. В основе образования иерархических структур белка лежат особенности распределения по поверхности структур аминокислотных остатков трех типов:
3,6. Отдельные ветки спирали связанные между собой водородными связями. β-структура представляет с собой складчатое образование, включение несколько параллельных цепей, связанных между собой водородными связями. Согласно классификации β и α структуры принадлежит вторичной структуре белка. К вторичной структуре относятся и наборы взаимодействующих между собой регуляторных комформоционных групп, состоящих из α- спиралей β-структур. Участки молекул стабилизируются в результате действие водородных связей, а так же гидрофобных воздействий между участками цепи. Установлено сопоставление между вторичной структурой белка и его аминокислотной последовательностью. На основе этих сопоставлений были сформулированы начальные принципы строение белка и правило сворачивания пептидной цепи во вторичную третичную структуру. Общая топография белковой глобулы определяется тем, что полярные группы расположены в основном на поверхности глобулы, а не полярные – внутри и образуют гидрофобное ядро. На поверхности основных элементов вторичной структуре α -спирали и β- пластины находятся целые гидрофобные области, внутримолекулярные водородные связи между пептидными границами максимально насыщены и стабилизируют глобулу. Различные типы белковых структур составляют структурную иерархию, которая отражает и последовательность стадий сворачивания от первичной структуры до глобулы. На самых ранних стадиях сворачивания в развёрнутой цепи образуются α и β участки вторичной структуры за счёт локальных взаимодействий с другими участками цепи с возникновением комплексов и доменов. Самозборка структуры белка носит направленный кооперативный характер она протекает через определённое чило промежулочных стадий, а не за счёт переборов всех возможных вариантов укладки до достижения минимального по энергетическому состоянию. Для статистической укладки глобулы потребовалось бы времени несоизмерно больше, чем реальное сворачивание глобулы. Выгодные низкоэнергетическое состояние появляются сразу на ранних этапах сворачивания 2-3 кислотных остатков. При этом среднее и дальнее взаимодействие не разрушают этих области, а лишь их стабилизируют. Т.е. вместо того, что бы пытатся сразу найти минимальную по энергетической конфигурации всей цепи, Находят в начале низкое энергетическое состояние дипептидов. Низко энергетические формы трипиктидов представляет с собой комбинации низкоэнергетических форм смежных дипептидов, сохранением низкоэнергетических форм. Известно, что белки выполняющие одинаковые функции в различных организмов могут отличатся по своей первичной последовательности. Однако, третичная структура одинакова. Способностью формировать α и β структуры с непременными гидрофобными поверхностями, обладают лишь некоторые аминокислотные остатки, т.е. для получения плотной упаковки белка нет необходимости абсолютно однозначно задавать его первичную последовательность, т.к. функциональные свойства белка определяются сравнительно не большими числами активных групп. В активном центре белка имеются 5-6 остатков, которые нельзя заменить без нарушения функциональных свойств, поэтому колебания не меняющих остатков в активном центре производятся совершенно однозначно при обязательном сохранении линии общих топографических черт глобулы. В основе образования иерархических структур белка лежат особенности распределения по поверхности структур аминокислотных остатков трех типов:
1. Гидрофобные боковые группы часть белковой молекулы в которой нет связи.
2. Длинные полярные боковые цепи.
3. Короткие полярные боковые цепи.
Реально осуществляется только такое распределения групп при котором на поверхности  - спирали и
- спирали и 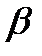 - структура возникают сплошные гидрофобные области. Тогда возникают вторичные структуры связанные с возможностью таких групп образовать связи между спиралями. Возникающие прочные связи между гидрофобными группами приводит к образованию плотного гидрофобного ядра глобулы. Ядро глобулы экранируется от водных соединении длинными гидрофобными группами. Т.о. процесс самоорганизации включает 3 связи:
- структура возникают сплошные гидрофобные области. Тогда возникают вторичные структуры связанные с возможностью таких групп образовать связи между спиралями. Возникающие прочные связи между гидрофобными группами приводит к образованию плотного гидрофобного ядра глобулы. Ядро глобулы экранируется от водных соединении длинными гидрофобными группами. Т.о. процесс самоорганизации включает 3 связи:
1. Формирование зародышей вторичной структуры за счет соединений гидрофобных групп;
2. Возникновение ядра глобулы за счет гидрофобных взаимодействий;
3. Возникновение третичной структуры белка, стабилизирующий всеми видами объемных взаимодействий.
Возникновение структуры глобулы основано на поэтапной оценке взаимодействия валентно не связанных атомов между собой или с растворителем. Устанавливается связь между валентно-несвязанными атомами, соответствует минимальной свободной энергии системы. Поэтому возникновение белковых структур проходит через последовательность локальных минимумов свободной энергии. Каждая последовательная установленная структура белка должна иметь минимум свободной энергии, меньшей, по сравнению с предыдущей структурой. Механизм изменения комформационного состояния белков связан с обменом энергии внутри молекулы и происходит не одновременно, а а состоит из отдельных этапов, при которых происходит передача энергии от одной группы атомов к другой.
Дата добавления: 2017-02-13; просмотров: 1852;











