Возможности масс-спектрометрии
По масс-спектру можно определить молекулярную массу вещества. Это необходимо для установления молекулярной формулы вещества (брутто-формула). Масса атома, измеренная с высокой точностью, отличается от массового числа. Так, для CO2 и C3H8 массовое число равно 44, но их точные относительные молекулярные массы равны соответственно 43,989828 и 44,062600, т.е. разница составляет 0,072772 а.е.м. Масс-спектрометр позволяет разделить пучки ионов CO2+ и C3H8+ , когда они получаются одновременно.
Определение атомного состава по точному значению массы проводится с использованием таблиц точных масс для различных соотношений числа атомов C, H, O и N как наиболее распространённых элементов. Точное измерение масс не заменяет элементного анализа. Оба метода взаимно дополняют друг друга.
При исследовании масс-спектра дополнительно к определению типа молекулярного иона (М+ ) измеряют пики и для изотопных ионов, включающих более легкие или более тяжелые изотопы (с массовыми числами М ± 1, М ± 2, М ± 3 и т.п.). Одновременное присутствие нескольких изотопов в молекуле маловероятно, т.к. естественная распространенность более тяжелых изотопов C, H, O и N незначительна. Например, 13C : 12C = 1×10-2; 2H : 1H = 1,6×10-4; 15N : 14N = 4×10-3 и т.д. Однако для хлора 35Cl : 37Cl = 3:1; для брома 79Br : 81Br = 1:1. Следовательно, в масс-спектре наряду с ионом М+ будет присутствовать ион (М+1)+ с интенсивностью, пропорциональной распространенности изотопов. В широко используемых справочных таблицах приводятся обычно соотношения интенсивностей пиков молекулярных ионов с массовыми числами М+1 и М+2.
Максимальное значение m/z в масс-спектре вещества может иметь молекулярный ион (М•+), масса которого равна молекулярной массе исследуемого соединения. Интенсивность пика молекулярного иона (М•+) тем выше, чем этот ион стабильнее.
Практически редко удается установить полную структуру соединения только на основе масс-спектра. Наиболее эффективно совместное использование нескольких физико-химических методов. Масс-спектрометрия, особенно в сочетании с хроматографией, является одним из наиболее информативных методов исследования структуры вещества (хроматомасс-спектрометрия).
Таким образом, возможности метода: определение молекулярной массы и брутто-формул веществ; установление строения вещества по характеру образующихся фрагментов; количественный анализ смесей, включая определение микропримесей; определение степеней чистоты вещества; определение изотопного состава вещества.
Рассмотрим в качестве примера масс-спектр этанола (рис. 2). Обычно спектр представляют в виде гистограмм.
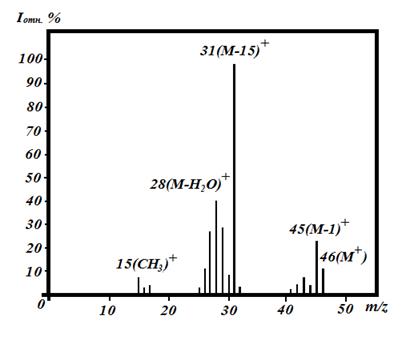
Рис. 2. Масс-спектр этанола
В современных приборах обработка интенсивности электрических импульсов, соответствующих пикам с различающимися значениями m/z, производится с помощью компьютера.
Масс-спектры приводят в такой записи: указывают значения m/z, а в скобках относительную интенсивность (%). Например, для этанола:
С2H5OH-масс-спектр (m/z): 15(9), 28(40), 31(100), 45(25), 46(14).
Вопросы для собеседования
1. Теоретические основы метода.
2. Энергия ионизации. Типы фрагментации.
3. Принципиальная схема масс-спектрометра.
4. Методы ионизации: электронный удар, химическая ионизация и др.
5. Закономерности фрагментации молекулярного иона.
6. Возможности масс-спектрометрии.
Тестовые задания
1. Типы фрагментации молекулярного иона:
а). Диссоциация - распад молекулярного иона с сохранением последовательности связей. В результате процесса образуются катион и радикал, образуются фрагменты с четными значениями отношения m/z.
Перегруппировка - изменение последовательности связей, образуется новый катион-радикал меньшей массы и нейтральная устойчивая молекула, фрагменты характеризуются нечетным значением отношения m/z.
б) Перегруппировка - распад молекулярного иона с сохранением последовательности связей. В результате процесса образуются катион и радикал, образуются фрагменты с нечетными значениями отношения m/z.
Диссоциация - изменение последовательности связей, образуется новый катион-радикал меньшей массы и нейтральная устойчивая молекула, фрагменты характеризуются четным значением отношения m/z.
в) Диссоциация - распад молекулярного иона с сохранением последовательности связей. В результате процесса образуются катион и радикал, образуются фрагменты с нечетными значениями отношения m/z.
Перегруппировка - изменение последовательности связей, образуется новый катион-радикал меньшей массы и нейтральная устойчивая молекула, фрагменты характеризуются четным значением отношения m/z.
2. Возможности метода масс-спектрометрии:
а) определение молекулярной массы и брутто-формул веществ, количественный анализ смесей;
б) установление строения вещества по характеру образующихся фрагментов, определение изотопного состава вещества;
в) определение молекулярной массы и брутто-формул веществ; установление строения вещества по характеру образующихся фрагментов; количественный анализ смесей, включая определение микропримесей; определение степеней чистоты вещества; определение изотопного состава вещества.
3. Выберите правильный ответ:
а) Вероятность разрыва связи С-Н уменьшается с увеличением цепи углеводорода; энергия разрыва связи С-С меньше; в ароматических производных наиболее вероятен разрыв β-связи с образованием перегруппировочного тропилиевого иона;
а) Вероятность разрыва связи С-Н уменьшается с увеличением цепи углеводорода; энергия разрыва связи С-С больше; в ароматических производных наиболее вероятен разрыв β-связи с образованием перегруппировочного тропилиевого иона;
в) Вероятность разрыва связи С-Н уменьшается с увеличением цепи углеводорода; энергия разрыва связи С-С меньше; в ароматических производных наиболее вероятен разрыв a-связи с образованием перегруппировочного тропилиевого иона;
Список рекомендуемой литературы
1. Казин В.Н., Урванцева Г.А. Физико-химические методы исследования в экологии и биологии: учебное пособие (гриф УМО) / В.Н. Казин, Г.А. Урванцева; Яросл. гос. ун-т им. П.Г. Демидова. - Ярославль, 2002. - 173 с.
2. Под. ред. А.А. Ищенко. Аналитическая химия и физико-химические методы анализа / Н.В. Алов и др. - М.: Издательский центр «Академия», 2012. (в 2-х томах, 1 том -352 с., 2 том - 416 с.) - (Сер. Бакалавриат)
3. Васильев В.П. Аналитическая химия. - кн. 2. Физико-химические методы анализа. М.: Министерство образования РФ. 2007. 383 c.
4. Харитонов Ю.Я. Аналитическая химия, кн. 1, кн. 2, Высшая школа, 2008.
5. Отто М. Современные методы аналитической химии (в 2-х томах). Москва: Техносфера, 2008.
6. Под ред. Ю.А. Золотова. Основы аналитической химии, Высш.шк., 2004.
7. Васильев В.П. Аналитическая химия. - кн. 2. Физико-химические методы анализа. М.: Дрофа, 2009.
8. Казин В.Н.Физико-химические методы анализа: лабораторный практикум / В.Н. Казин, Т.Н. Орлова, И.В. Тихонов; Яросл. гос. ун-т им. П.Г. Демидова.- Ярославль: ЯрГУ, 2011. – 72 с.
Дата добавления: 2017-02-13; просмотров: 3083;











