Закономерности фрагментации
Распад молекулярного иона осуществляется всегда значительно легче, т.к. он менее стабилен по сравнению с исходной молекулой. С ростом длины и особенно разветвленности цепи углеводородного радикала увеличивается число вероятных направлений распада молекулярного иона и соответственно уменьшается интенсивность его пика.
Дальнейший ход расшифровки масс-спектра основывается на закономерностях фрагментации. Предполагаемый путь фрагментации проверяют анализом положений пиков неустойчивых ионов.
Примером установленных закономерностей фрагментации являются следующие схемы разрыва связей:
1. В разветвленных углеводородах наиболее вероятен разрыв связей у места ветвления:
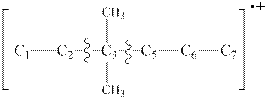
2. Вероятность разрыва связи С-Н уменьшается с увеличением цепи углеводорода. Энергия разрыва связи С-С меньше, поэтому, сначала происходит ее разрыв.
3. В ароматических производных наиболее вероятен разрыв β-связи с образованием перегруппировочного тропилиевого иона (С7Н7+) по схеме:
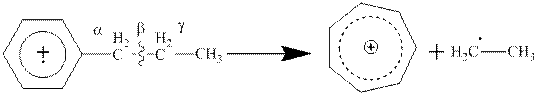
4. В масс-спектрах спиртов характерными осколочными ионами являются фрагменты с массами 31 и М-1, которые соответствуют следующей схеме разрыва связей:
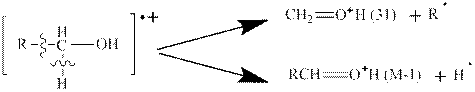
Предполагают, что при образовании ионов происходит стабилизация за счет образования кратной связи СН2=О+Н(31) или RCH=О+Н(М-1).
5. Для аминов H2N-CH2-R характерен разрыв связи с образованием иона N2H=CH2 (30). Значительным по интенсивности также является пик для иона H2N+=CHR (М-1):
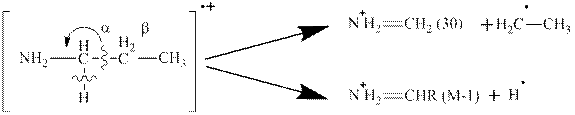
6. В непредельных системах углеводородная цепь разрывается в β-положении к двойной связи и образуется устойчивый аллильный радикал:
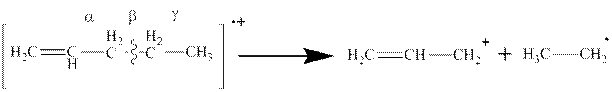
7. Масс-спектр кетонов содержит сигналы ионов и радикалов:
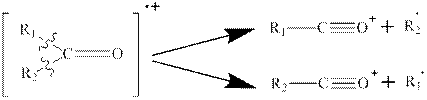
Если алкильная цепь содержит три или более атомов углерода, то происходит разрыв β-связи и далее перегруппировка с участием атома водорода:
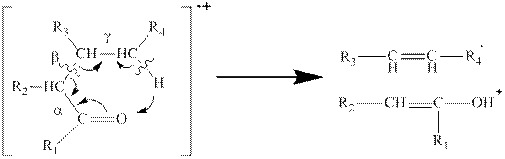
Подобные и более детальные закономерности установлены для многих классов соединений. Они позволяют в определенной мере объяснить и предсказать фрагментацию молекулярных ионов и, обратно, на основании масс-спектра установить химическое строение молекул.
Дата добавления: 2017-02-13; просмотров: 1729;











