Применение ЭПР-спектроскопии
Метод ЭПР приобрел большое значение в химии, физике, биологии, медицине, поскольку позволяет определять структуры и концентрации органических и неорганических свободных радикалов. Свободные радикалы могут быть созданы химическим методом, фотохимически или при действии излучения высокой энергии.
Спектр ЭПР дают свободные радикалы, молекулы с нечетным числом электронов, триплетные состояния органических молекул, парамагнитные ионы переходных металлов и их комплексы.
Метод ЭПР начал применятся в биологических исследованиях в 50-ые годы 20 в. Благодаря довольно высокой чувствительности и возможности в определении природы парамагнитных частиц этот метод нашел широкое применение для изучения целого ряда биологических процессов.
Помимо сигналов свободных радикалов в тканях наблюдается целый ряд сигналов металлов (Fe, Cu, Mn, Ni, Co). Эти металлы входят в состав металлопротеинов, принимающих участие в целом ряде ферментативных процессов. Железосодержащие белки (цитохромы, ферредоксины) являются компонентами электрон-транспортных цепей в митохондриях и хлоропластах.
Методом ЭПР исследован целый ряд ферментативных систем, обнаружены свободно-радикальные продукты субстратов. В ряде случаев оказалось возможным наблюдать за окислительно-восстановительными превращениями ионов металлов, входящих в активный центр фермента.
ЭПР-спектроскопия широко применяется в исследованиях фотосинтеза: изучается механизм первичных стадий разделения зарядов в реакционных центрах и дальнейший перенос электрона по цепи электронного транспорта.
Помимо изучения механизмов реакций, протекающих с участием парамагнитных частиц, метод ЭПР широко используют и для исследования структурно-динамических свойств макромолекул и биомембран.
В последнее время для изучения биологических и полимерных систем часто используются методы «парамагнитного зонда», «спиновых меток» и «спиновых ловушек». Все они основаны на использовании стабильных азотнокислых радикалов различного строения, а точнее на анализе изменений ширины линий спектров ЭПР, вызванных вращательной и поступательной диффузией этих радикалов.
Основная идея метода спиновых меток и зондов состоит в присоединении к той или иной функциональной группе белка свободного радикала и изучению характеристик его сигналов ЭПР. Наиболее удобны в этом отношении нитроксильные радикалы, содержащие свободнорадикальную группу:

где R1 и R2 – различные химические группировки.
Метод «спиновых меток» заключается в том, что к непарамагнитной молекуле стабильный радикал прикрепляется ковалентной или какой-либо другой связью так, чтобы свободная валентность оказалась незатронутой. Характер движения отчетливо проявляется в форме спектра и служит важным источником информации об исходной молекуле.
Если молекула встраивается в белковую молекулу и там удерживается с помощью электростатических сил или гидрофобных взаимодействий, то такая молекула называется спиновым зондом.Метод основан на исследовании вращательной и поступательной подвижности радикала-зонда в водных или органических средах или в матрице полимера. Подвижность радикала зависит от подвижности молекул окружающей среды, поэтому радикал является своеобразным молекулярным датчиком структурной и динамической информации о локальном окружении.
Форма сигнала ЭПР, даваемого спиновой меткой или зондом, зависит от микроокружения нитроксильного радикала и, в первую очередь, от вращательной подвижности той группы, в состав которой он входит.
Основной недостаток спиновых меток и зондов заключается в том, что хотя эти молекулы и невелики, всё же, включаясь в липидный бислой, они несколько изменяют его свойства.
В основе метода «спиновых ловушек» лежит реакция специально вводимой в исследуемую систему непарамагнитной молекулы (ловушки) с короткоживущим радикалом, при этом образуется стабильный радикал. Кинетическое поведение образующегося стабильного радикала и его структура дают сведения о кинетике и механизме процессов в изучаемой системе.
Объектами исследования в химии с применением ЭПР-спектроскопии являются: 1) свободные радикалы в промежуточных продуктах органических реакций; 2) кинетика реакций; 3) химия поверхностных явлений; 4) разрушение, происходящее в результате облучения; 5) полимеризация, обусловленная свободными радикалами; 6) свободные радикалы, замороженные при низких температурах; 7) металлы переменной валентности и их комплексы.
Метод ЭПР дает ценный вклад в исследование кинетики и механизмов химических реакций. Во-первых, измерение ширины линий в спектрах ЭПР можно использовать для определения констант скорости процессов с участием парамагнитных частиц, характеристическое время жизни которых лежит в интервале 10-5-10-10 с. Во-вторых, метод ЭПР позволяет регистрировать с высокой чувствительностью в разных условиях парамагнитные частицы, что дает ценную информацию о механизмах реакций. В-третьих, спектрометр ЭПР можно использовать как аналитический прибор для детектирования в ходе реакций концентрации реагирующих парамагнитных молекул. Количество парамагнитных центров в образце пропорционально площади под спектром поглощения.
Метод ЭПР широко используется для исследования быстрых процессов, связанных с изменением молекулярной структуры радикалов. Эти процессы включают заторможенное вращение и конформационные переходы.
Для короткоживущих радикалов чувствительность метода может быть повышена путем использования проточной системы или непрерывного облучения. Спектры ЭПР нестабильных радикалов можно получить, зафиксировав их в стеклах, матрицах замороженных благородных газов или кристаллах.
Вопросы для собеседования
1. Теоретические основы метода.
2. Аналитические параметры ЭПР-спектра.
3. Спектрометры ЭПР.
4. Применение ЭПР.
Тестовые задания
1. Условие резонанса в методе ЭПР:
а) n= gH0 (1-s) / 2p; б) δ = (ΔН/Н0);·в)hn=gβH0; г) δ = (Δν/ν0)/(ΔН/Н0).
2. Что происходит в момент резонанса в методе ЭПР:
а) происходит поглощение квантов излучения, переориентации спинов не происходит;
б) происходит поглощение квантов излучения и переориентации спинов, т.е. переход из нижнего энергетического состояния в верхнее и наоборот. Количество переходов снизу вверх больше числа переходов сверху вниз.
в) происходит поглощение квантов излучения и переориентации спинов, т.е. переход из нижнего энергетического состояния в верхнее и наоборот. Количество переходов сверху вниз больше числа переходов снизу вверх.
3. Параметры спектров ЭПР:
а) g-фактор, ширина полосы поглощения, интенсивность линии поглощения;
б) общее число сигналов, интенсивность сигналов, химический сдвиг, мультиплетность сигнала;
в) g-фактор, ширина полосы поглощения, интенсивность линии поглощения, СТС спектров ЭПР.
МАСС-СПЕКРОМЕТРИЯ
Данный метод принципиально отличается от спектроскопических методов. Методы масс-спектрометрии основаны на ионизации вещества, разделении ионов, согласно отношению (m/z), и регистрации массы образующихся осколков.
Теоретические и экспериментальные основы масс-спектрометрии были заложены еще Д.Д. Томсоном, который впервые в 1912 г. создал прибор для получения масс-спектра положительных ионов. Однако его прибор имел низкое разрешение. Его ученик Ф. Астон в 1918 г. существенно повысил разрешение и на своем приборе впервые открыл изотопы элементов. Практически одновременно с Ф. Астоном в Чикаго А. Демпстер сконструирован первый масс-спектрометр, в котором анализатором служило поперечное магнитное поле, а ионные токи измерялись электрическими методами. Схема его используется и в современных приборах.
Ионизация молекул должна проводиться в таких условиях, при которых образовавшийся ион вне зависимости от метода ионизации не претерпевал бы никаких столкновений с другими молекулами или ионами. Это необходимо для установления взаимосвязи между свойствами иона и молекулы.
Методы ионизации
Ионизация может проводиться различными методами.
1. Метод ионизации электронным ударом (ЭУ).
Это наиболее распространенный метод получения ионов в связи с простотой и доступностью источников ионов и их высокой эффективностью. Допустим, что через пары вещества проходит поток электронов, энергию которых можно постепенно увеличивать. Если эта энергия достигнет определенного уровня, то при столкновении электрона с молекулой может произойти «выбивание» из нее электрона с образованием молекулярного иона:

многоатомная молекула молекулярный ион (катион-радикал)
Наименьшая энергия бомбардирующих электронов, при которой возможно образование из данной молекулы иона, называется энергией ионизации вещества. Энергия ионизации является мерой прочности, с какой молекула удерживает наименее связанный с ней электрон. Для органических молекул энергия ионизации составляет 9 ÷12 эВ.
Если энергия электронов значительно превышает энергию ионизации, то образующийся молекулярный ион получает избыточную энергию, которой может оказаться достаточно для разрыва в нем связей. Происходит распад молекулярного иона на частицы меньшей массы (фрагменты). Такой процесс называется фрагментацией. В практике масс-спектрометрии используются электроны с энергией 30÷100 эВ, что обеспечивает фрагментацию молекулярного иона.
Молекулярные ионы - это такие ионы, массы которых равны массе ионизируемой молекулы. К сожалению, нет прямых методов определения структуры ионов. Поэтому часто используют предположение о тождественности структуры молекулярного иона (М•+) и нейтральной молекулы (М). Вероятность образования молекулярного иона больше для простых, малых молекул. С увеличением числа атомов в молекуле увеличивается вероятность фрагментации молекулярного иона.
Известны два основных типа фрагментации молекулярного иона - диссоциация и перегруппировка.
Диссоциация - распад молекулярного иона с сохранением последовательности связей. В результате процесса образуются катион и радикал:
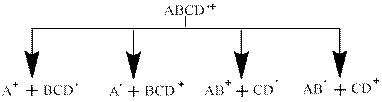
Диссоциация углеводородов приводит к фрагментам с нечетными значениями отношения m/z.
Перегруппировка сопровождается изменением последовательности связей, в результате чего образуется новый катион-радикал меньшей массы и нейтральная устойчивая молекула (Н2О, СО, СО2 и т.д.):
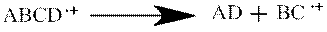
Перегруппировка углеводородов и кислородсодержащих соединений приводит к фрагменту с четным значением отношения m/z. Измерение массы образующихся осколков и их относительного количества позволяет получить ценную информацию о строении органических соединений.
Рассмотрим устройство масс-спектрометра (рис. 1). Масс-спектрометр должен содержать узлы для выполнения следующих функций: 1) ионизации пробы, 2) ускорение ионов электрическим полем, 3) распределение ионов согласно отношению m/z, 4) детектирование ионов по соответствующему электрическому сигналу.
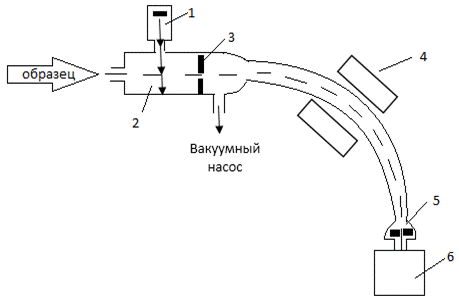
Рис.1. Устройство масс-спектрометра
1 - источник электронов; 2 - ионизационная камера; 3 - ускорительные пластины (отрицательный потенциал); 4 - магнит; 5 - щель;
6 - коллектор ионов (детектор ионов)
Для получения масс-спектра пары вещества небольшими количествами с помощью специальной системы напуска вводятся в ионизационную камеру (2), где поддерживается глубокий вакуум (давление 10-6 мм рт. ст.). Молекулы вещества бомбардируются потоком электронов, излучаемых раскаленным катодом (1). Образующиеся ионы выталкиваются из ионизационной камеры небольшой разностью потенциалов (3). Получаемый поток ионов ускоряется, фокусируется сильным электрическим полем и попадает в магнитное поле (4).
В результате бомбардировки молекул вещества электронами образуются частицы, имеющие положительный или отрицательный заряд, а также нейтральные частицы. При прохождении потока частиц через магнитное поле нейтральные частицы не изменяют направления, а положительные и отрицательные отклоняются в разные стороны. Величины отклонения ионов пропорциональны заряду и обратно пропорциональны их массе.
Каждый отдельный ион, характеризуемый конкретной величиной m/z, при данной напряженности магнитного поля движется по собственной траектории. Интервал сканирования масс можно изменять, варьируя либо напряженностью магнитного поля, либо потенциалом электрического поля.
В обычной масс-спектрометрии принято регистрировать только частицы, имеющие положительный заряд, т.к. при бомбардировке молекул электронами положительно заряженных ионов обычно больше, чем отрицательно заряженных. Если необходимо изучать и отрицательно заряженные ионы, следует изменить знак потенциала ускорения (ускорительные пластины).
Если на выходе ионов из магнитного поля установить регистрирующее устройство, то частицы, различающиеся значениями m/z, будут давать раздельные сигналы. Интенсивность сигналов будет пропорциональна количеству частиц с данным значением m/z. Интенсивность сигналов определяется как их высота, выраженная в мм. Высота пика с максимальной интенсивностью принимается за 100 % (базовый пик), интенсивность остальных пиков пересчитывается пропорционально и выражается в процентах.
С ростом отношения m/z разница в отклонении магнитным полем частиц, различающихся на одну атомную единицу массы, уменьшается. В связи с этим важной характеристикой масс-спектрометров является их разрешающая способность (R), определяющая максимальную массу ионов, различающихся на одну атомную единицу массы (для которой прибор разделяет пики не менее чем на 90%):
R = M / ΔM
где М - максимальная масса, для которой перекрывание пиков менее 10%; ΔМ - одна атомная единица массы.
Стандартные приборы имеют R ≈ 5000/1, а для приборов с двойной фокусировкой потока ионов R ≈ 10000/1 и даже больше. Такие приборы способны уловить разницу в молекулярной массе ионов до 0,0001. Масс-спектрометр с двойной фокусировкой может легко разделить пики ионов с одинаковыми номинальными величинами молекулярных масс, но разным элементным составом. Например, может различить N2 (28,0061), CO (27,9949), и C2H4 (28,0313).
Установление эмпирической формулы по данным масс-спектров задача не простая, но ее можно решить, используя подходящий алгоритм. Для получения масс-спектра требуется ничтожно малое количество вещества - около 1 мкг.
2. Химическая ионизация (ХИ).
В этом методе образец до облучения пучком электронов разбавляют большим избытком «газа-реагента». Вероятность первичных ионизирующих столкновений между электронами и молекулами образца после этого настолько мала, что первичные ионы образуются почти исключительно из молекул реагента. В качестве реагентов обычно используют газы с низкой молекулярной массой, например, CH4, изо-C4H10, NH3 и инертные газы (Ar, He). Вторичные ионы образуются в результате переноса атома водорода или электрона.
Если газом-реагентом служит метан, то реакции протекают в такой последовательности:
CH4 + ē → CH4+ + 2ē
CH4+ + ē → CH3+ + H+ + 2ē
CH4+ + CH4 → CH5+ + CH3
CH3+ + CH4 → C2H5+ + H2
R-CH3 + CH5+ → R-CH4+ + CH4
где R-CH3 - молекула исследуемого вещества.
Исследования показали, что частицы CH5+ и C2H5+ в сумме составляют около 90% ионов, присутствующих в этой системе. Масс-спектры, получаемые после химической ионизации, намного проще, содержат меньше пиков, и поэтому их часто легче интерпретировать.
Дата добавления: 2017-02-13; просмотров: 5043;











