Теоретические основы люминесценции
ЛЮМИНЕСЦЕНТНЫЕ МЕТОДЫ АНАЛИЗА: ФЛУОРЕСЦЕНЦИЯ И ФОСФОРЕСЦЕНЦИЯ
Люминесценцией называют свечение вещества, возникающее при переходе молекул из возбужденного состояния в основное.
Люминесценция - довольно распространенное явление. Перевод молекул в возбужденное состояние может осуществляться различными путями, как и расходование приобретенной при этом молекулами энергии. Если возбуждение происходит за счет поглощения электромагнитного излучения в оптической области, то испускание излучения называют фотолюминесценцией.
Хемилюминесценция представляет собой испускание света в результате протекания определенных химических реакций (например, окисление эфирных растворов n-бромфенилбромида магния вызывает зеленовато-голубое свечение).
К числу разновидностей люминесценции, которые наблюдаются в природе, относится молния (пример электролюминесценции).
Некоторые виды бактерий, ракообразных, рыб, грибов, медуз, моллюсков, губок, червей обладают способностью светиться (известный пример - светляки). Такое явление называется биолюминесценцией. Оно обусловлено реакцией кислорода с веществом, находящимся в организме, которое называют люциферином. Эта реакция катализируется ферментом люциферазой.
Теоретические основы люминесценции
При нормальных условиях в отсутствии возбуждения молекулы находятся в основном синглетном (S0) состоянии (рис. 1). На схеме изображены также ряд других энергетических уровней молекул: синглетные возбужденные состояния - S1, S2 и т. д., для каждого синглетного состояния существует соответствующее триплетное состояние (T1, T2 и т. д.) Каждый из этих электронных энергетических уровней имеет ряд подуровней, которые отвечают квантовым колебательным энергетическим состояниям.
Сплошными вертикальными линиями показаны поглощение или испускание излучения; пунктирными - безызлучательные переходы.
Энергия, поглощенная молекулой, вызывает переход на один из более высоких уровней (этот процесс обозначен на схеме цифрой 1). Если переход заканчивается на каком-либо колебательном подуровне возбужденного уровня S1, то молекула очень быстро переходит на уровень S1, при этом энергия выделяется в виде тепла (этот процесс обозначен цифрой 2 – безызлучательный переход).
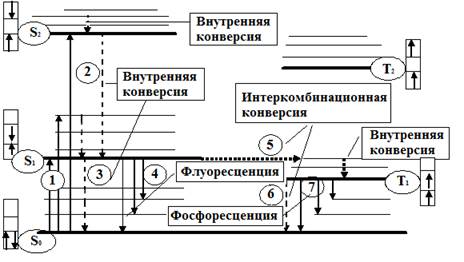
Рис. 1. Схематическое изображение изменений в уровнях энергии
молекулы, которые могут происходить при поглощении излучения
Рассмотрим различия между возбужденным синглетным и соответствующим триплетным состояниями. Возбужденный электрон синглетного состояния имеет спин, антипараллельный электрону, с которым он был спарен. В триплетном состоянии два внешних электрона имеют один и тот же спин, т. е. они не могут подойти близко друг к другу без нарушения принципа Паули.
Принципа Паули: на каждом заполненном электрическом уровне могут находиться только два электрона, имеющие противоположные собственные магнитные моменты (спины).
Поскольку в этом случае электроны удалены друг от друга, происходит уменьшение электронного взаимодействия, поэтому триплетное состояние всегда обладает более низкой энергией, чем соответствующее синглетное состояние. Около каждого уровня в клетках (соответствующих разным орбиталям) показано направление возбужденного электрона по отношению к спину оставшегося электрона.
Если молекуле сообщить энергию (квант света), то произойдет переход одного электрона с заполненного уровня (S0) на один из незаполненных уровней. Молекула при этом оказывается в электронно-возбужденном состоянии. При переходах между синглетными уровнями (S1, S2 и т. д.) спин электрона не изменяется.
Молекула в возбужденном состоянии S1 может с определенной вероятностью реализовать следующие пути превращения поглощенной энергии:
а) передача энергии возбуждения другой молекуле (колебательная релаксация); б) превращение в тепло (безызлучательный переход – процесс 3): S1 ®S0; в) фотохимическая реакция: S1 ® продукт; г) испускание ее в виде излучения (на схеме - процесс 4): S1 ®S0 + hvфл.
Излучение, испускаемое при переходе между состояниями, имеющую одинаковую мультиплетность, называется флуоресценцией.
д) переход молекулы с S1 на один из колебательных подуровней (близкий по энергии) триплетного возбужденного состояния (T1) c обращением спина электрона: S1®T1 (безизлучательный переход – процесс 5).
Переходы с изменением мультиплетности запрещены, это значит, что процесс возможен с малой вероятностью.
Процессы безызлучательного перехода происходят очень быстро (с временем порядка 10-3 – 10-12 с). К этим быстрым процессам относятся:
а) внутренняя конверсия; б) интеркомбинационная конверсия.
Внутренней конверсией называется безызлучательный переход энергии из возбужденных состоянияний без изменения мультиплетности.
Это означает, что в какое бы возбужденное состояние ни попала молекула (например S2), она очень быстро переходит в первое синглетное состояние (S)1. Внутренняя конверсия может происходить и между возбужденными триплетными состояниями (Т2 ® T1).
Интеркомбинационной конверсией называются безызлучательные переходы между состояниями различной мультиплетности (например, S1 ®T1). На схеме процесс обозначен цифрой 5.
Рассмотрим молекулу, находящуюся в возбужденном триплетном состоянии T1. Существует несколько путей растраты энергии из данного состояния молекулы:
а) безызлучательный переход в S0 с обращением спина электрона (интеркомбинационная конверсия): T1 ® S0 (процесс обозначен цифрой 6);
б) фотохимическая реакция; в) передача энергии возбуждения другой молекуле; г) испускание кванта фосфоресценции (процесс 7):
T1 ® S0 + hvфосф.
Излучение, испускаемое при переходе между состояниями с различной мультиплетностью, называется фосфоресценцией.
Время жизни флуоресценции органических молекул составляет 10–9 - 10–8 с, а время жизни фосфоресценции - от 10–3 секунд до нескольких секунд, потому что переходы между состояниями с различной мультиплетностью очень мало вероятны.
Обсудим более подробно происхождение спектров флуоресценции и фосфоресценции. Рассмотрим зависимость потенциальной энергии (Е) двухатомной молекулы (для простоты) от межатомного расстояния (r). На рис. 2 изображены кривые потенциальной энергии и колебательные подуровни основного (S0) и первого (S1) синглетного состояния двухатомной молекулы.
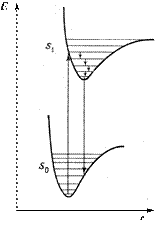
Рис. 2. Поглощение и флуоресценция двухатомной молекулой
Минимумы кривых потенциальных энергий в основном и возбужденном состоянии сдвинуты, поскольку орбиталь, заполняемая электронами в возбужденном состоянии, занимает большую область пространства, чем в основном состоянии, и положение равновесия в возбужденном состоянии соответствует большему межъядерному расстоянию.
Принцип Франка-Кондона: наиболее вероятным будет такой электронный переход, при котором не произойдет изменений ни в межъядерном расстоянии, ни в импульсе (принцип вертикальности перехода - изображается вертикальной линией).
Из сопоставления длин стрелок на рис. 2 ясно, что фотоны испускаемого излучения обычно обладают меньшей энергией, и следовательно, большей длинной волны, чем фотоны возбуждающего излучения.
Если в соответствии с принципом Франка-Кондона представить состояния двухатомной молекулы, способной переходить в триплет, в виде потенциальных кривых, то кривые (S1) и (T1) должны пересекаться в некоторой точке М (рис. 3).
При поглощении света молекула переходит из основного состояния (S0) в первое электронно-возбужденное состояние (S1). Молекула быстро теряет избыток колебательной энергии. В точке пересечения (S1) положения и импульсы ядер для возбужденного синглетного уровня и первого триплетного уровня (T1) оказываются одинаковыми. Это означает, что молекула может перейти на соответствующий подуровень триплетного состояния. При этих условиях вероятность того, что такой переход произойдет - велика, несмотря на правило отбора, согласно которому переходы между состояниями с различной мультиплетностью запрещены. Далее потеря колебательной энергии в состоянии Т1 продолжается благодаря внутренней конверсии.
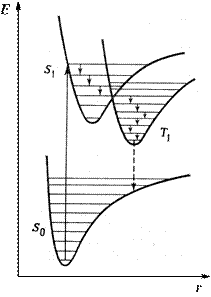
Рис. 3. Поглощение и фосфоресценция двухатомной молекулой
Поскольку состояние Т1 обладает более низкой энергией, чем состояние S1, то спектр фосфоресценции наблюдается при больших длинах волн, чем спектр флуоресценции.
Таким образом, одним из способов отдачи энергии при переходе из возбужденного состояния в основное является испускание кванта света люминесценции. Чаще всего таким фотоэлектроном сложных органических молекул является p-электрон, участвующий в образовании делокализованных двойных сопряженных связей молекулы. Сами переходы с поглощением и испусканием света в системе p-электронов представляют переходы типа p-p* и p*-p между основным и возбужденным синглетным состоянием.
Дата добавления: 2017-02-13; просмотров: 2535;











