Водородная связь. Комплементарность
Водородная связь – это особый вид межмолекулярной связи, которая осуществляется при участии атомов водорода одной молекулы и атомами с большой электроотрицательностью 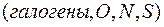 другой молекулы. Схематически эта связь обозначается тремя точками:
другой молекулы. Схематически эта связь обозначается тремя точками:
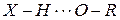
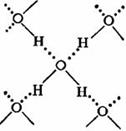
Водородная связь широко проявляется в органических соединениях, кристаллогидратах и многих других, но наиболее ярко она выступает в воде и во льду, обуславливая ее аномальные свойства: высокую температуру кипения, увеличение плотности при плавлении льда, существование в парах димерных молекул 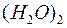 и др.
и др.
Кроме того, водородная связь может возникать и внутри одной молекулы (в органических веществах), приводя к замыканию цикла. Это так называемая внутримолекулярная водородная связь.
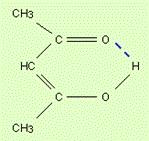
Таким образом, атом 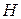 становится своеобразным мостиком, соединяющим два фрагмента
становится своеобразным мостиком, соединяющим два фрагмента 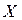 и
и 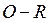 разных молекул(межмолекулярная водородная связь) или одной молекулы (внутримолекулярная водородная связь), т.е. возникает пространственное соответствие этих структур, благодаря которому и осуществляется водородная связь. Это так называемая структурная или пространственная комплементарность. Термин комплементарность наибольшее распространение получил в биохимии и биоорганической химии, которое в широком смысле обозначает взаимное соответствие, обеспечивающее связь дополняющих друг друга структур (фрагментов) и определяемое их химическими свойствами. Комплементарные структуры подходят друг к другу как ключ к замку.
разных молекул(межмолекулярная водородная связь) или одной молекулы (внутримолекулярная водородная связь), т.е. возникает пространственное соответствие этих структур, благодаря которому и осуществляется водородная связь. Это так называемая структурная или пространственная комплементарность. Термин комплементарность наибольшее распространение получил в биохимии и биоорганической химии, которое в широком смысле обозначает взаимное соответствие, обеспечивающее связь дополняющих друг друга структур (фрагментов) и определяемое их химическими свойствами. Комплементарные структуры подходят друг к другу как ключ к замку.
Прочность водородной связи значительно меньше ковалентной: если прочность первой связи в среднем составляет ~ 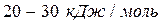 , то второй –
, то второй – 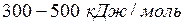 .
.
Ионная связь
Основой для выделения этой связи в отдельный тип служит то обстоятельство, что она осуществляется посредством электростатического притяжения между противоположно заряженными ионами. Причём её возникновение возможно между атомами, обладающими большой разницей в электроотрицательности 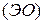 :
: 
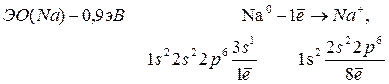
т.е. атомы металлов отдают электроны внешнего слоя, а образующиеся положительно заряженные ионы (катионы) имеют завершенные электронные структуры (октет).
С другой стороны:
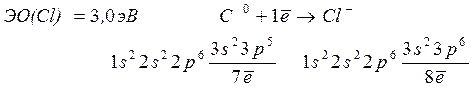
атомы неметаллов принимают такое количество электронов, какое им необходимо для завершения электронного октета, образуя отрицательно заряженные ионы (анионы).
Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщаемости. Поэтому каждый ион в ионном соединении притягивает к себе определённое число ионов противоположного знака, образуя кристаллическую решетку ионного типа. Поэтому в ионном кристалле нет отдельных молекул.
Ионных соединений немного. Они имеют высокие температуры плавления и кипения. В расплавленном состоянии и в водных растворах многие их них диссоциируют на ионы, а, следовательно, проводят электрический ток.
Резкой границы между ионной и ковалентной связями не существует, так как даже в таких соединениях как 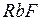 и
и 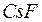 сохраняется некоторая доля ковалентной связи. Поэтому ионную связь можно рассматривать как крайний случай полярной ковалентной связи, когда общая электронная пара полностью смещается к атому с большей электроотрицательностью.
сохраняется некоторая доля ковалентной связи. Поэтому ионную связь можно рассматривать как крайний случай полярной ковалентной связи, когда общая электронная пара полностью смещается к атому с большей электроотрицательностью.
Тип связи между атомами 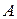 и
и 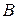 можно определить по разности электроотрицательностей
можно определить по разности электроотрицательностей 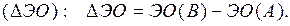
Если разница 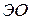 составляет
составляет 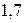 , то степень ионности связи соответствует примерно
, то степень ионности связи соответствует примерно 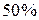 . При разнице между
. При разнице между 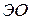 большей, чем
большей, чем 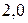 , по мнению Полинга, вещество следует рассматривать с позиции ионной структуры. Если же разница находиться в пределах
, по мнению Полинга, вещество следует рассматривать с позиции ионной структуры. Если же разница находиться в пределах 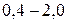 , то вещество следует описывать с точки зрения ковалентной структуры с частично ионным характером; при разнице менее
, то вещество следует описывать с точки зрения ковалентной структуры с частично ионным характером; при разнице менее 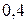 связь считается чисто ковалентной.
связь считается чисто ковалентной.
Таблица 4.1 – Разность 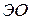 элементов и степень ионности связи
элементов и степень ионности связи
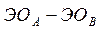
| 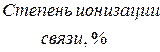
| 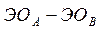
| 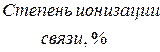
|
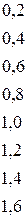
| 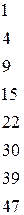
| 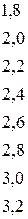
| 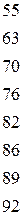
|
Если же различие между электроотрицательностями атомов ближе к 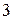 , то можно говорить о полном переходе электронной пары к более электроотрицательному атому.
, то можно говорить о полном переходе электронной пары к более электроотрицательному атому.
Дата добавления: 2016-06-05; просмотров: 2062;











