Полициклические ароматические углеводороды
Бензо[α]пирен – типичный пример соединения, которое может участвовать в обмене веществ на разных стадиях. Это пятикольцевое соединение имеет 11 участков гидроксилирования и 4 участка образования диолов. Так же могут образовываться хиноны. Один из наиболее активных метаболитов БП 7,8-дигидродиол-9,10 эпоксид взаимодействует с ДНК с образованием аддукта (Рис. 21).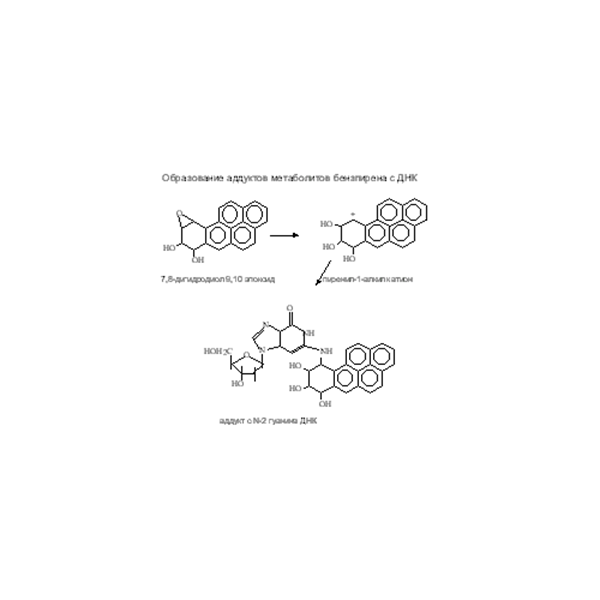 Рис. 21. Образование аддукта БП с ДНК
Рис. 21. Образование аддукта БП с ДНК
Нитрозоамины
Важность нитрозоаминов как объекта токсикологии стала очевидной в 1950-е годы, когда было показано, что диметилнитрозамин, промышленный растворитель, способен вызывать повреждение печени у машинистов. В 1960-е годы были зарегистрированы множественные случаи отравления овец, связанные с образованием в их пище, обогащенной рыбой (содержащей высокое количество аминов), нитрозаминов. Вскоре было показано, что нитрозамины являются мощными канцерогенами для животных. Было изучено около 300 нитрозаминов, из которых 90% проявляли канцерогенные свойства. Все протестированные виды, включая лабораторных животных и обезьян, оказались восприимчивыми к нитрозаминам. Все это явилось предпосылкой для их тщательного изучения. Нитрозоамины используемые в различных областях промышленности, представлены во множестве потребительских товаров (напитки, косметика, табачные изделия). По мере изучения многих стадий образования нитрозоаминов были предприняты шаги для уменьшения степени риска, например, путем использования альтернативных промышленных процессов. Нитрозоамины формируются и эндогенно, из аминов и нитратов (или нитритов), содержащихся в нашей пище. Ограничение нитратов и нитритов приводит к значительному снижению уровня нитрозаминов. Нитрозамины быстро формируются из вторичных аминов и азотистой кислоты, а соответствующие N-нитрозосоединения - из первичных аминов. Донором нитрогруппы является ангидрид азотистой кислоты. Поэтому скорость прямой реакции пропорциональна квадрату концентрации азотистой кислоты. Скорость реакции зависит от концентрации вторичных аминов, квадрата концентрации азотистой группы и константы, связанной с рН. Скорость реакции увеличивается в кислых условиях (после превращения нитрита в азотистую кислоту), но амины активны в депротонированной форме, которая преобладает при высоких рН. В результате для многих аминов оптимальным является рН 2-4, близкий к рН желудка. Амины различаются по их способности превращаться в нитрозамины в основном в зависимости от величины рКа. H+ HNO2→H2O R2NH ↓ ↓ NO2- → HNO2 → O=N-O-N=O → R2N-NO + HNO2 → 2 HNO2 + R2NH → R2N-NO + HNO2 + H2O Скорость образования = k[R2NH][HNO2]2 = k’[amine][nitrite]2 , где k’ = f (pH) Как показано ниже, образование нитрозаминов в условиях нейтральной рН катализируется формальдегидом, который широко представлен в окружающей человека среде. Повышение оптимума рН возможно благодаря образованию Шиффова основания с депротонированными аминами. Важно отметить, что скорость реакции пропорциональна первой степени концентрации нитрита. Это обозначает, что формальдегид способен значительно ускорить реакцию, когда концентрация нитрита низкая. ONO- + ↓H2CO + R2NH → R2N=CH2 → ONOCH-NR2 → R2N-NO + H2CO Реакция образования нитрозаминов катализируется также тиоцианатом, который также широко представлен в окружающей среде. Например, в слюне курильщика это соединение может достигать 6мМ концентрации. Оптимум рН также кислый, но скорость реакции пропорциональна концентрации азотистой кислоты в первой степени. R2NH ↓-NCS + H+ + HNO2 → H2O + ON-NCS → R2N-NO + H+ + -NCS Оксиды азота, образующиеся в атмосфере, могут способствовать образованию нитрозаминов. В процессе горения из азота образуется оксид азота NO, который затем превращается в диоксид азота, как показано ниже. Далее происходит гидратация до азотной и азотистой кислот. Это явление достаточно легко протекает на влажной поверхности (включая поверхность слизистых). Образование нитрозаминов в процессах, например, пивоварения, производства табака, а также в районах добычи газа, происходит согласно следующей реакции:N2 + O2 → 2 NO → 2 NO2 → HNO2 + HNO3 Ряд овощей содержат значительное количество нитратов. Многие виды бактерий, включая микрофлору полости рта, могут приводить к образованию нитритов из нитратов. По предварительным оценкам, бактерии, представленные в ротовой полости, способны продуцировать приблизительно 1 мг нитритов из 20 мг нитратов, содержащихся в суточном рационе (несмотря на значительные межиндивидуальные различия). В последующем происходит их накопление в желудке. Одной из наиболее опасных реакций, которой подвергаются нитрозамины, является гидроксилирование по α-углероду (следующему за функциональной группой N-NO). В результате образуется нестабильный продукт, который подвергается спонтанному распаду с образованием альдегидов (по сайту гидроксилирования), алкилирующих агентов (где активным является негидроксилированный α-углерод), N2 и –ОН. Алкилирующие агенты могут реагировать с гидроксидами (или водой) или глютатиономи, таким образом, происходит их детоксикация. Однако их реакции с ДНК часто лежат в основе канцерогенных эффектов у животных. Известно, что человеческий организм способен метаболизировать нитрозамины путем α-гидроксилирования. Следовательно, нет оснований надеяться, что человек нечувствителен к нитрозаминам как к канцерогенам. Был проведен сравнительный анализ скоростей метаболизма диметилнитрозамина (известный канцероген для многих видов, исключая людей, для которых он является мощным гепатотоксином) в печени. Было показано, что в печени человека происходит образование примерно 45% аддуктов с ДНК (N7 метилгуанин), в печени крыс образуется 65% аддуктов, а в печени обезьян и форели 6% и 0,1% соответственно, если за 100% принять количество аддуктов, образующихся в идентичных условиях в печени хомяков. Несмотря на то, что нитрозамины проявляют канцерогенный эффект по отношению ко всем позвоночным, у разных видов позвоночных часто разные ткани имеют различную чувствительность к ним. Это явление может быть объяснено разницей в содержании изоформ цитохрома Р450 (ферменты 1 фазы метаболизма ксенобиотиов), ферментов конъюгации (II фаза метаболизма ксенобиотиков) и/или различиями в системах репарации ДНК. Так, трансплацентарное воздействие на зародышей крыс нитрозометилмочевиной, активной в неметаболизированном виде, приводило к возникновению опухолей мозга. Было показано, что преимущественно в клетках мозга происходило метилирование ДНК, в других тканях аддукты с ДНК не образовывались или происходило их образование в незначительных количествах. Воздействие метилбензилнитрозамина также тканеспецифично (Табл. 5). Это соединение вызывает рак пищевода у крыс. Был проведен ряд экспериментов, когда крыс в течение некоторого времени кормили пищей, содержащей метилбензилнитрозамин, а далее анализировали различные ткани. Было показано, что в пищеводе образуется 390 мкмоль аддуктов (N7 – и О6 метилгуанин) на моль гуанина, в то время как в печени происходило образование 125, в ткани легкого 73, в почке 3 и в желудке 2 мкмоль аддуктов на моль гуанина. Этот факт можно объяснить тем, что в клетках пищевода цитохромы Р450 преимущественно воздействуют на α-углерод, смежный с гидрофобным фенольным кольцом. А, например, в печени интенсивно гидроксилируются оба α-углерода. Интересно, что в печени метилбензилнитрозамин метаболизируется эффективнее, чем в пищеводе, но ДНК аддуктов образуется меньше. Это может быть следствием того, что в печени более активны защитные реакции (ферменты II фазы метаболизма ксенобиотиков и ферменты репарации ДНК), чем в пищеводе. С этим согласуется и тот факт, что диметилнитрозамин проявляет канцерогенный эффект по отношению к печени, но не к пищеводу крыс. Некоторые соединения, относящиеся к нитрозоамидам, проявляют те же свойства, что и активированные(гидроксилированные) нитрозамины. Нитрозометилмочевина и метилнитронитрозогуанидин являются производными мочевины и гуанидина, соответственно. Они спонтанно разлагаются в водном растворе и широко используются в качестве экспериментальной модели метилирующих агентов. Некоторые пищевые продукты (например, бобовые) содержат соединения, схожие с метилмочевиной, которые легко присоединяют нитрогруппу и могут становиться опасными для потребителей. Табл| Соединение | Продукт метаболизма | Скорость метаболизма (нмоль/мин/мг белка) печень/пищевод |
| Метилбензилнитрозамин | бензальдегид | 3.0/0.55 |
| Метилбензилнитрозамин | формальдегид | 0.3/0.005 |
| Диметилбензилнитрозамин | формальдегид | 0.9/0.03 и меньше |
Дата добавления: 2019-09-30; просмотров: 853;











