Гетероциклические амины
Метод Эймса, предложенный в 1970-х, несмотря на свои значительные ограничения, обеспечил быстрый и недорогой способ анализа уровня канцерогенности химических веществ без вовлечения лабораторных животных и позволил увеличить скорость их очистки. Так, были довольно быстро протестированы компоненты табачного дыма и доказан их мутагенный эффект для бактерий. Далее был исследован дым, образующийся при приготовлении мяса, который также оказался сильным мутагеном. До этого, в 1939, было показано, что органические соединения, образующиеся в процессе жаренья лошадиного мяса, вызывают у мышей рак молочной железы, предположительно за счет формирования при этом ПАУ. В 1970-х эти исследования были продолжены. Появилось предположение, что источником канцерогенных агентов являются не ПАУ, а аминокислоты и белки, содержащиеся в мясе. При изучении этих компонентов был идентифицирован класс мутагенных гетероциклических аминов. Например, сильными мутагенами являются образующиеся изтриптофана агенты Trp-P-1 и Trp-P-2. Это послужило поводом для тщательного систематического изучения всех аминокислот. Гетероциклические амины образуются при пиролизе аминокислот, содержащихся в белках. Структуры некоторых гетероциклических аминов представлены на рис. 25.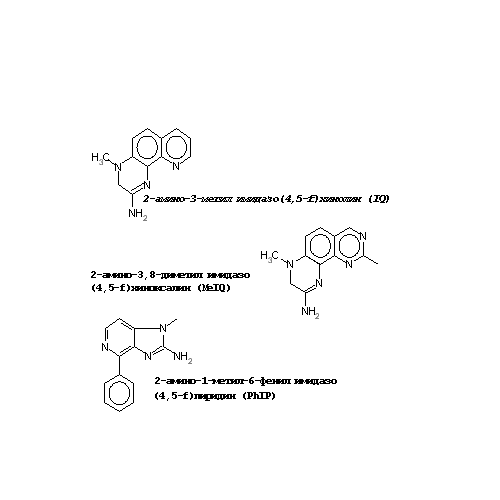 Другой важный класс мутагенов был идентифицирован при изучении смеси аминокислот с креатинином и моносахаридами. Эти ингридиенты содержатся в сыром мясе и гораздо более эффективны в комбинации, чем поодиночке, в отношении появления мутагенных свойств при приготовлении пищи. Для образования мутагенов критичной является температура приготовления пищи. Так, например, для формирования Trp-P-1 и Trp-P-2 требуются более высокие температуры, чем для дериватов фенилаланина, поэтому последние более широко распространены в США. Для снижения риска представляется возможным ограничение хорошо приготовленного и прожаренного мяса в пище. Очистку гетероциклических аминов и их мониторинг осуществляли, основываясь на предположении, что агенты, вызывающие мутации у бактерий, с большой вероятностью являются канцерогенами для животных. Мутагенная активность у многих из этих агентов очень велика. Несмотря на различия в уровне активности среди различных гетероциклических аминов, большинство из них являются более активными, чем даже такие мощные канцерогены животных, как афлатоксин В1 и бензо(а)пирен. Гетероциклические амины проявляют высококанцерогенные свойства по отношению к крысам и мышам. Особенного внимания заслуживают производные фенилаланина. Хотя ни один из них не является сильным бактериальным мутагеном, они в большом количестве содержатся в приготовленном мясе, и, например, проявляют высококанцерогенные свойства по отношению к грызунам. А в экспериментах на культурах тканей было показано, что эти соединения приводят к образованию аддуктов с ДНК, причем у людей в гораздо большей степени, чем у грызунов. У крыс они инициируют развитие опухолей кишечника, простаты и молочной железы. По предположению ряда исследователей, и у человека за развитие опухолей данной локализации гетероциклические амины ответственны в гораздо большей степени, чем жиры, содержащиеся в мясе и ранее рассматривающиеся как основной канцерогенный агент. В дальнейшем многие работы были посвящены оценке степени риска развития онкозаболеваний в зависимости от концентрации гетероциклических аминов в пище. В неметаболизированном виде гетероциклические амины не активны, не проявляют мутагенных и канцерогенных свойств. Их активация происходит при гидроксилировании аминогруппы. Гидроксиламин в некоторых случаях нестабилен и теряет воду с образованием активного иона, способного формировать аддукты с макромолекулами, такими, как ДНК и белки. Чаще гидроксиламин подвергается конъюгации с сульфатом или ацетатом. Такие конъюгаты подвергаются выведению из организма. Тканевая специфичность действия гетероциклических аминов связана, таким образом, с ферментами 1 фазы (гидроксилирование) и 2 фазы (конъюгация) метаболизма ксенобиотиков и с ферментами системы репарации ДНК. В клетке существует несколько ферментных путей, ответственных за превращение нитрогруппы в аминогруппу. Например, нитрогруппа может быть последовательно превращена в нитрозо, затем гидроксиламин и, наконец, в амины. Гетероциклические амины являются субстратами для цитохрома Р450 (главным образом для CYP1A2). Они подвергаются N–деалкилированию (в случае содержания N-алкильных групп) или N-гидроксилированию экзо-аминогрупп с образованием арилгидроксиаминов. Последние могут далее подвергаться действию N,O-ацетил- трансфераз или сульфотрансфераз. В результате образуются высокоактивные N-ацетокси- и N-сульфо-эфиры , которые образуют аддукты с ДНК. Эпидемиологические исследования показали строгую корреляцию между факторами питания и возникновением рака, причем некоторые сообщения предполагают взаимосвязь между потреблением пережаренного мяса и определенными типами рака человека. Некоторые гетероциклические амины класса аминоимидазоазарена (АИА) были изолированы из пережаренного мяса. Многие из них были мутагенами в тесте Эймса и канцерогенами для грызунов. Около 75% от всех гетероциклических аминов этого класса представлено 2-амино-1-метил-6-фенилимидазо[4,5b]пиридином (PhIP). Было показано, что это соединение вызывает рак грудной железы и кишечника у крыс и лимфому у мышей. Учитывая его канцерогенность для грызунов и высокое содержание в пище, можно предположить его потенциальную опасность в этиологии рака у человека. Для проявления генотоксичности таких соединений необходима метаболическая активация цитохромом Р450, особенно CYP1A2, в N-гидроксиметаболиты. Образовавшиеся в результате окисления метаболиты далее подвергаются О-ацетилированию N-ацетилтрансферазами NAT1 и NAT2, либо могут экскретироваться в виде глюкуронидов с желчью, проходя затем деконъюгацию, осуществляемую кишечной флорой, и окончательно выводятся из организма через О-ацетилирование кишечной формой NAT. Тогда одним из факторов, определяющим риск заболевания колоректальным раком, который, как предполагают, индуцируется этими токсинами, может быть активность ферментов детоксикации, т. е. NAT2. Доказано, что PhIP индуцирует более 32-х видов мутаций. Эпидемиологические исследования, проведенные в Китае, показали, что среди женщин, болеющих раком разной этиологии, 60% приходится на рак легкого, хотя большинство китайских женщин не курит. В связи с этим, интерес был сосредоточен на поиске других факторов, включая пассивное курение, дым против комаров, сгорание угля в домашних печах, масло для жарки пищи, которые могли бы влиять на столь высокий процент данной патологии. Был проведен множественный логистический регрессионный анализ факторов риска заболевания раком легкого на Тайване, который выявил существенную роль мутагенных-канцерогенных компонентов, образующихся в результате приготовления пищи. Были проанализированы аэрозольные компоненты пищи, образующиеся после жарки. Показано, что основным компонентом смеси пирогенных гетероциклических аминов является 2-амино-3,8-диметилимидазо[4,5-f]хиноксалин, обладающий высоким мутагенным потенциалом.
Другой важный класс мутагенов был идентифицирован при изучении смеси аминокислот с креатинином и моносахаридами. Эти ингридиенты содержатся в сыром мясе и гораздо более эффективны в комбинации, чем поодиночке, в отношении появления мутагенных свойств при приготовлении пищи. Для образования мутагенов критичной является температура приготовления пищи. Так, например, для формирования Trp-P-1 и Trp-P-2 требуются более высокие температуры, чем для дериватов фенилаланина, поэтому последние более широко распространены в США. Для снижения риска представляется возможным ограничение хорошо приготовленного и прожаренного мяса в пище. Очистку гетероциклических аминов и их мониторинг осуществляли, основываясь на предположении, что агенты, вызывающие мутации у бактерий, с большой вероятностью являются канцерогенами для животных. Мутагенная активность у многих из этих агентов очень велика. Несмотря на различия в уровне активности среди различных гетероциклических аминов, большинство из них являются более активными, чем даже такие мощные канцерогены животных, как афлатоксин В1 и бензо(а)пирен. Гетероциклические амины проявляют высококанцерогенные свойства по отношению к крысам и мышам. Особенного внимания заслуживают производные фенилаланина. Хотя ни один из них не является сильным бактериальным мутагеном, они в большом количестве содержатся в приготовленном мясе, и, например, проявляют высококанцерогенные свойства по отношению к грызунам. А в экспериментах на культурах тканей было показано, что эти соединения приводят к образованию аддуктов с ДНК, причем у людей в гораздо большей степени, чем у грызунов. У крыс они инициируют развитие опухолей кишечника, простаты и молочной железы. По предположению ряда исследователей, и у человека за развитие опухолей данной локализации гетероциклические амины ответственны в гораздо большей степени, чем жиры, содержащиеся в мясе и ранее рассматривающиеся как основной канцерогенный агент. В дальнейшем многие работы были посвящены оценке степени риска развития онкозаболеваний в зависимости от концентрации гетероциклических аминов в пище. В неметаболизированном виде гетероциклические амины не активны, не проявляют мутагенных и канцерогенных свойств. Их активация происходит при гидроксилировании аминогруппы. Гидроксиламин в некоторых случаях нестабилен и теряет воду с образованием активного иона, способного формировать аддукты с макромолекулами, такими, как ДНК и белки. Чаще гидроксиламин подвергается конъюгации с сульфатом или ацетатом. Такие конъюгаты подвергаются выведению из организма. Тканевая специфичность действия гетероциклических аминов связана, таким образом, с ферментами 1 фазы (гидроксилирование) и 2 фазы (конъюгация) метаболизма ксенобиотиков и с ферментами системы репарации ДНК. В клетке существует несколько ферментных путей, ответственных за превращение нитрогруппы в аминогруппу. Например, нитрогруппа может быть последовательно превращена в нитрозо, затем гидроксиламин и, наконец, в амины. Гетероциклические амины являются субстратами для цитохрома Р450 (главным образом для CYP1A2). Они подвергаются N–деалкилированию (в случае содержания N-алкильных групп) или N-гидроксилированию экзо-аминогрупп с образованием арилгидроксиаминов. Последние могут далее подвергаться действию N,O-ацетил- трансфераз или сульфотрансфераз. В результате образуются высокоактивные N-ацетокси- и N-сульфо-эфиры , которые образуют аддукты с ДНК. Эпидемиологические исследования показали строгую корреляцию между факторами питания и возникновением рака, причем некоторые сообщения предполагают взаимосвязь между потреблением пережаренного мяса и определенными типами рака человека. Некоторые гетероциклические амины класса аминоимидазоазарена (АИА) были изолированы из пережаренного мяса. Многие из них были мутагенами в тесте Эймса и канцерогенами для грызунов. Около 75% от всех гетероциклических аминов этого класса представлено 2-амино-1-метил-6-фенилимидазо[4,5b]пиридином (PhIP). Было показано, что это соединение вызывает рак грудной железы и кишечника у крыс и лимфому у мышей. Учитывая его канцерогенность для грызунов и высокое содержание в пище, можно предположить его потенциальную опасность в этиологии рака у человека. Для проявления генотоксичности таких соединений необходима метаболическая активация цитохромом Р450, особенно CYP1A2, в N-гидроксиметаболиты. Образовавшиеся в результате окисления метаболиты далее подвергаются О-ацетилированию N-ацетилтрансферазами NAT1 и NAT2, либо могут экскретироваться в виде глюкуронидов с желчью, проходя затем деконъюгацию, осуществляемую кишечной флорой, и окончательно выводятся из организма через О-ацетилирование кишечной формой NAT. Тогда одним из факторов, определяющим риск заболевания колоректальным раком, который, как предполагают, индуцируется этими токсинами, может быть активность ферментов детоксикации, т. е. NAT2. Доказано, что PhIP индуцирует более 32-х видов мутаций. Эпидемиологические исследования, проведенные в Китае, показали, что среди женщин, болеющих раком разной этиологии, 60% приходится на рак легкого, хотя большинство китайских женщин не курит. В связи с этим, интерес был сосредоточен на поиске других факторов, включая пассивное курение, дым против комаров, сгорание угля в домашних печах, масло для жарки пищи, которые могли бы влиять на столь высокий процент данной патологии. Был проведен множественный логистический регрессионный анализ факторов риска заболевания раком легкого на Тайване, который выявил существенную роль мутагенных-канцерогенных компонентов, образующихся в результате приготовления пищи. Были проанализированы аэрозольные компоненты пищи, образующиеся после жарки. Показано, что основным компонентом смеси пирогенных гетероциклических аминов является 2-амино-3,8-диметилимидазо[4,5-f]хиноксалин, обладающий высоким мутагенным потенциалом.
Мышьяк
Источники воздействия -Питьевая вода. Поверхность воды (реки, резервуары) в редких случаях может содержать высокий уровень мышьяка. -горнодобывающая и перерабатывающая промышленности. Руды ценных металлов часто содержат примеси мышьяка. Остаточные количества мышьяка могут загрязнять окружающую среду (включая воду) и вместе с пылью попадать в легкие. При плавке мышьяк высвобождается в воздух. -пестициды. Некоторые формы мышьяка (мышьяковистый натрий, монометил и диметил мышьяка) используются для уничтожения муравьев, грызунов, сорняков. - медикаменты. Ранее мышьяк применялся для лечения некоторых болезней, однако, сейчас его использование прекращено. Эпидемии из-за экспозиции высокой дозой из питьевой воды. - Тайвань. В течении более 50 лет люди в засушливых регионах пили воду с высоким содержанием мышьяка из колодцев, которые бурились для создания запасов воды. После того как среди популяции в 130 000 человек обнаружилось широкое распространение рака кожи, запасы воды пришлось заменить - Север Чили. В области вокруг Антофагасты население в 400 000 человек в течении 20-30 лет использовало речную воду с высоким содержанием мышьяка. В результате было отмечено большое количество рака кожи, мочевого пузыря и легких. - Индия и Бангладеш. Вода в этих регионах была настолько загрязнена, что в конце 1960-х правительству пришлось пробурить множество новых скважин, для обеспечения населения чистой водой. В 1980-е г. Начали отмечать большое количество рака кожи. Риску были подвергнуты несколько миллионов человек. Симптомы хронической экспозиции.-Гиперпигментация, пигментные пятна. - Гиперкератоз. Утолщение кожи на ладонях и стопах. Появляются наросты, подобные бородавкам. - Рак. Рак кожи преобладал в Тайваньской популяции в результате экспозиции мышьяком. Недавние исследования показали, что более вероятно может возникать рак мочевого пузыря. Замечено увеличение случаев рака легких. - Проблемы с циркуляцией крови. Клетки, окаймляющие кровеносные сосуды повреждаются при экспозиции мышьяком. В Тайване это приводило к случаям гангрены.Арсенит. Это соединение обладает высокой аффинностью к сульфгидрилам, особенно к вицинальным. Он является слабой кислотой и в норме ионизуется в биологических жидкостях, что способствует его прохождению сквозь мембрану путем диффузии. Арсенит быстро связывается с дигидролипоамидом, что сопровождается острой токсической реакцией. Это приводит к разрывам в цепи переноса электронов, восстановлению NAD+ + H+ до NADH и переносом ацетата на ацетил кофермент А, как показано на рис. 26.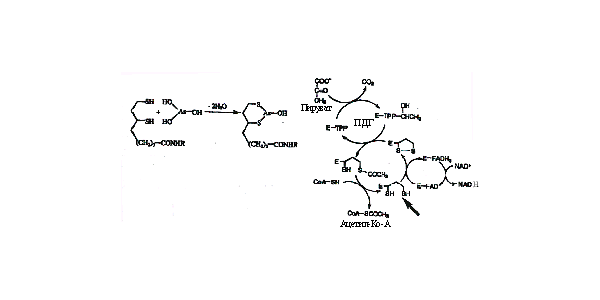 Рис. 26. Пируват дегидрогеназа (ПДГ), используя кофактор тиамин пирофосфат (TPP), превращает пируват в ацетил кофермент А. Дигидролипоил дегидрогеназа (ДЛДГ) генерирует ДГЛ 1,3-дитиол (показано стрелкой), отвечающий за связывание металлов. Е - фермент. Аффинность арсенита к вицинальным сульфгидрилам объясняет его способность к инактивации глюкортикоидных рецепторов в клетках в микромолярных концентрациях, без изменения остальных стероидных рецепторов. Только первый имеет вицинальный остаток цистеина в стероид-связывающей области. Как можно было бы ожидать, эта реакция ингибируется высокими концентрациями дексаметазона, высокоаффинного лиганда. Производное мышьяка, 2-хлорвинил дихлорарсин использовалось как химическое оружие. Антидотом для него является 2,3-меркаптопропанол. Это соединение связывается с арсенатом, однако обнаружено, что оно проходит через гемато-энцефалический барьер.
Рис. 26. Пируват дегидрогеназа (ПДГ), используя кофактор тиамин пирофосфат (TPP), превращает пируват в ацетил кофермент А. Дигидролипоил дегидрогеназа (ДЛДГ) генерирует ДГЛ 1,3-дитиол (показано стрелкой), отвечающий за связывание металлов. Е - фермент. Аффинность арсенита к вицинальным сульфгидрилам объясняет его способность к инактивации глюкортикоидных рецепторов в клетках в микромолярных концентрациях, без изменения остальных стероидных рецепторов. Только первый имеет вицинальный остаток цистеина в стероид-связывающей области. Как можно было бы ожидать, эта реакция ингибируется высокими концентрациями дексаметазона, высокоаффинного лиганда. Производное мышьяка, 2-хлорвинил дихлорарсин использовалось как химическое оружие. Антидотом для него является 2,3-меркаптопропанол. Это соединение связывается с арсенатом, однако обнаружено, что оно проходит через гемато-энцефалический барьер. 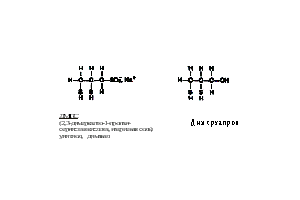 Арсенат. Эта форма имеет геометрическое сходство с фосфатом, кроме того, она имеет аналогичную рКа и может транспортироваться в клетку с помощью переносчиков фосфата. Это соединение не обладает аффинностью к сульфгидрилам и поэтому значительно менее токсично для клеток. Но оно может вытеснять фосфат в метаболических реакциях, нарушая выработку энергии, как показано на рис. 27. Это соединение может формировать эфиры мышьяка с малыми молекулами, включая АДФ. Эти эфиры нестабильны и легко гидролизуются. Арсенаты хоть и являются слабыми мутагенами, но обладают заметной кластогенной (разрушающей хромосомы) активностью, возможно, вследствие низкого уровня формирования диэфиров мышьяка в остове ДНК.
Арсенат. Эта форма имеет геометрическое сходство с фосфатом, кроме того, она имеет аналогичную рКа и может транспортироваться в клетку с помощью переносчиков фосфата. Это соединение не обладает аффинностью к сульфгидрилам и поэтому значительно менее токсично для клеток. Но оно может вытеснять фосфат в метаболических реакциях, нарушая выработку энергии, как показано на рис. 27. Это соединение может формировать эфиры мышьяка с малыми молекулами, включая АДФ. Эти эфиры нестабильны и легко гидролизуются. Арсенаты хоть и являются слабыми мутагенами, но обладают заметной кластогенной (разрушающей хромосомы) активностью, возможно, вследствие низкого уровня формирования диэфиров мышьяка в остове ДНК. 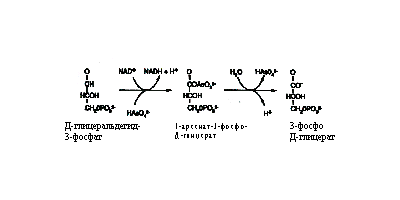 Метилированные аренаты. Это детоксифицированные формы, которые легко экскретируются у животных, почти не оказывая биологического эффекта (однако недавние исследования показали, что высокая доза этих соединений оказывает опухолегенный эффект). Концепция существования критического пути детоксикации привела к предположению, что может существовать безопасный способ выведения неорганического мышьяка. Некоторые эпидемиологи полагают, что присутствие менее 100 µМ мышьяка в питьевой воде не оказывает эффекта, и существующие стандарты по мышьяку можно повышать. Однако в недавних исследованиях, проведенных в Индии и Китае, был продемонстрирован биологический эффект дозы мышьяка менее чем 100 µМ. По-видимому, риск возникновения рака мочевого пузыря выше, чем риск возникновения рака кожи. Эпидемиологические исследования с учетом эффекта метилирования могут быть полезными в установлении стандартов для питьевой воды. Некоторые исследователи полагают, что риск возникновения мышьяк-индуцированного рака повышается при ингибировании реакций метилирования. Биологические воздействия мышьяка, предположительно способствующие канцерогенезу: Ответ на стресс. Обработка клеток мышьяком индуцирует некоторые белки теплового шока (heat-shock response), что приводит к изменениям в работе множества генов. Мышьяк индуцирует киназу стрессового ответа (JNK), однако в летальной концентрации 50 µМ. Допустимая концентрация менее 3 µМ не индуцирует эту киназу. Трансформация клеток. Показано, что при обработке мышьяком иммортализованных клеток грызунов в культуре последние приобретают морфологическое сходство со злокачественными клетками. Мышьяк предположительно действует как промотор поздних стадий рака у человека. Амплификация генов. Трансформированные клетки, обработанные антиметаболитами, часто развивают резистентность, аналогичную той, что имеет место при химиотерапии. Показано, что иммортализованные клетки мышей линии 3Т6 развивают резистентность к метотрексату (ингибитор дигидрофолат редуктазы) путем амплификации ДНК, кодирующей фермент-мишень. Скорость амплификации стимулируется арсенитом или (в больших концентрациях) арсенатом. Предполагается, что арсенит дестабилизирует репарацию ДНК, действуя как опухолевый промотор. Показано, что арсенит ингибирует ДНК-лигазу, однако в очень высоких (летальных) концентрациях.
Метилированные аренаты. Это детоксифицированные формы, которые легко экскретируются у животных, почти не оказывая биологического эффекта (однако недавние исследования показали, что высокая доза этих соединений оказывает опухолегенный эффект). Концепция существования критического пути детоксикации привела к предположению, что может существовать безопасный способ выведения неорганического мышьяка. Некоторые эпидемиологи полагают, что присутствие менее 100 µМ мышьяка в питьевой воде не оказывает эффекта, и существующие стандарты по мышьяку можно повышать. Однако в недавних исследованиях, проведенных в Индии и Китае, был продемонстрирован биологический эффект дозы мышьяка менее чем 100 µМ. По-видимому, риск возникновения рака мочевого пузыря выше, чем риск возникновения рака кожи. Эпидемиологические исследования с учетом эффекта метилирования могут быть полезными в установлении стандартов для питьевой воды. Некоторые исследователи полагают, что риск возникновения мышьяк-индуцированного рака повышается при ингибировании реакций метилирования. Биологические воздействия мышьяка, предположительно способствующие канцерогенезу: Ответ на стресс. Обработка клеток мышьяком индуцирует некоторые белки теплового шока (heat-shock response), что приводит к изменениям в работе множества генов. Мышьяк индуцирует киназу стрессового ответа (JNK), однако в летальной концентрации 50 µМ. Допустимая концентрация менее 3 µМ не индуцирует эту киназу. Трансформация клеток. Показано, что при обработке мышьяком иммортализованных клеток грызунов в культуре последние приобретают морфологическое сходство со злокачественными клетками. Мышьяк предположительно действует как промотор поздних стадий рака у человека. Амплификация генов. Трансформированные клетки, обработанные антиметаболитами, часто развивают резистентность, аналогичную той, что имеет место при химиотерапии. Показано, что иммортализованные клетки мышей линии 3Т6 развивают резистентность к метотрексату (ингибитор дигидрофолат редуктазы) путем амплификации ДНК, кодирующей фермент-мишень. Скорость амплификации стимулируется арсенитом или (в больших концентрациях) арсенатом. Предполагается, что арсенит дестабилизирует репарацию ДНК, действуя как опухолевый промотор. Показано, что арсенит ингибирует ДНК-лигазу, однако в очень высоких (летальных) концентрациях.
ТХДД
При исследованиях регуляции токсичных процессов большой интерес представляет соединение, известное как диоксин или 2,3,7,8-тетрахлородибензо-р-диоксин (ТХДД) (Рис. 28).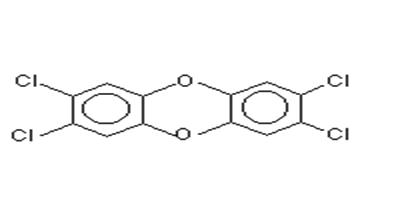 Рис. 28. Структура 2,3,7,8-тетрахлодибензо-p-диоксина Это сильнодействующее соединение, оказывающее вредное воздействие на многие виды животных. ТХДД образуется при нагревании хлорированных фенолов или при горении хлорсодержащих углеводородов, входящих в некоторые виды пластика. В окружающей среде в заметных количествах ТХДД обнаруживается со времен 2-ой мировой войны в связи с развитием нефтеперерабатывающей промышленности. В прошлом большое количество ТХДД выбрасывалось в окружающую среду в результате аварий на производстве, связанном с хлорированием фенолов и, как загрязнения, при рутинном синтезе хлорированных фенольных продуктов (определенные гербициды). В малых количествах ТХДД обнаруживается как побочный продукт при хлорировании органических материй (отбеливание бумаги). Однако по оценкам экспертов половина ТХДД, генерируемого ежегодно в США, образуется в результате сгорания отходов. Горение при достаточно высоких температурах приводит к распаду ТХДД, однако такая температура обычно не достигается. ТХДД известен как сильный канцероген для ряда видов животных. У мышей, крыс, хомячков, рыб, обрабатываемых длительное время этим соединением, быстро развиваются опухоли. Некоторые исследователи полагают, что ТХДД является первичным промотором, вызывая рак при кормлении в течение длительного периода. Они полагали, что это соединение просто усиливает развитие опухолей, возникающих из-за эндогенных повреждений ДНК. Идея была привлекательна, поскольку сам по себе ТХДД не взаимодействовал с ДНК и не образовывал аддукты. Более того, биотрансформация ТХДД происходит слабо, и высоко реакционноспособные метаболиты не образуются с необходимой скоростью. ТХДД не является промотором в общем случае, он неэффективен для самцов крыс и некоторых видов мышей. Помимо рака ТХДД оказывает ряд негативных эффектов. В организме человека он метаболизируется с образованием хлорина, который удерживается от 5 до 20 лет, а сам ТХДД удерживается в жировой ткани и выводится медленно. Время его полувыведения оценивается в 1 год и более. У мышей во время внутриутробного развития он вызывает появление расщепленного неба. Также это соединение препятствует созреванию Т-лимфоцитов в тимусе, т.е. ТХДД является иммуносупрессором. Среди разных видов животных существует ярко выраженная дозо-зависимость: например, у морских свинок LD50 составляет 2 мкг/кг веса, а у хомячков более 5000 мкг/ кг веса. В табл. 6 приведены данные о чувствительности разных видов к токсину: Табл. 6. Чувствительность к ТХДД
Рис. 28. Структура 2,3,7,8-тетрахлодибензо-p-диоксина Это сильнодействующее соединение, оказывающее вредное воздействие на многие виды животных. ТХДД образуется при нагревании хлорированных фенолов или при горении хлорсодержащих углеводородов, входящих в некоторые виды пластика. В окружающей среде в заметных количествах ТХДД обнаруживается со времен 2-ой мировой войны в связи с развитием нефтеперерабатывающей промышленности. В прошлом большое количество ТХДД выбрасывалось в окружающую среду в результате аварий на производстве, связанном с хлорированием фенолов и, как загрязнения, при рутинном синтезе хлорированных фенольных продуктов (определенные гербициды). В малых количествах ТХДД обнаруживается как побочный продукт при хлорировании органических материй (отбеливание бумаги). Однако по оценкам экспертов половина ТХДД, генерируемого ежегодно в США, образуется в результате сгорания отходов. Горение при достаточно высоких температурах приводит к распаду ТХДД, однако такая температура обычно не достигается. ТХДД известен как сильный канцероген для ряда видов животных. У мышей, крыс, хомячков, рыб, обрабатываемых длительное время этим соединением, быстро развиваются опухоли. Некоторые исследователи полагают, что ТХДД является первичным промотором, вызывая рак при кормлении в течение длительного периода. Они полагали, что это соединение просто усиливает развитие опухолей, возникающих из-за эндогенных повреждений ДНК. Идея была привлекательна, поскольку сам по себе ТХДД не взаимодействовал с ДНК и не образовывал аддукты. Более того, биотрансформация ТХДД происходит слабо, и высоко реакционноспособные метаболиты не образуются с необходимой скоростью. ТХДД не является промотором в общем случае, он неэффективен для самцов крыс и некоторых видов мышей. Помимо рака ТХДД оказывает ряд негативных эффектов. В организме человека он метаболизируется с образованием хлорина, который удерживается от 5 до 20 лет, а сам ТХДД удерживается в жировой ткани и выводится медленно. Время его полувыведения оценивается в 1 год и более. У мышей во время внутриутробного развития он вызывает появление расщепленного неба. Также это соединение препятствует созреванию Т-лимфоцитов в тимусе, т.е. ТХДД является иммуносупрессором. Среди разных видов животных существует ярко выраженная дозо-зависимость: например, у морских свинок LD50 составляет 2 мкг/кг веса, а у хомячков более 5000 мкг/ кг веса. В табл. 6 приведены данные о чувствительности разных видов к токсину: Табл. 6. Чувствительность к ТХДД | ВИД | Способ передачи | LD50 (мг/кг) | ED50 (мг/кг) |
| Свинья | перорально | 0.5-1 | |
| Обезьяна | перорально | ||
| Крыса | через легкие | 25-60 | |
| Кролик | перорально | ||
| через кожу | |||
| Мышь | через легкие | ||
| Хомяк | через легкие | >3000 | >300 |
| перорально |
Курение
Врачи указывают на табак как наиболее важную причину смертности в США. Рак легких убивает порядка 100000 американцев в год. Из этой цифры 90% случаев обусловлено курением. Но наиболее распространенная причина смерти (200 тыс. случаев в год), связана с сердечно-сосудистыми заболеваниями, которые вызваны курением. Пагубные эффекты табака на здоровье человека известны в медицинской литературе с давних пор. В 1845 году французский врач сделал заявление, что из 68 его пациентов, страдающих раком ротовой полости, 67 курят табак. В 1927 году английский врач отметил, что почти все его пациенты с раком легких были курящими. В 1936 году 90% случаев рака легких было вызвано курением. Исследования в 1930, 1950 и 1952 годах обеспечили прочную основу для вывода, что курение вызывает рак, но так как данные были ретроспективные, они были отклонены. В последующих исследованиях, выполняемых британскими и американскими врачами в 1956 и 1958 годах, соответственно, наблюдения велись в течение нескольких лет. Полученные результаты не отличались существенным образом от имеющихся ранее. В 1961 году американское общество по изучению рака, американская общественная ассоциация здоровья, а также другие здравоохранительные организации потребовали, чтобы новоизбранный президент Кеннеди предпринял шаги для защиты американского общества против угрозы, исходящей от табака. Как результат, в 1962 году появились голубые ленточные щиты с обзорами медицинской литературы и рекомендациями. Увеличение употребления табака в США началось после Второй мировой войны, частично из-за изобретения механизма. увеличивающего объем производства сигарет, и частично из-за пагубной привычки вернувшихся солдат, которые получали сигареты в пайках во время войны. Резкое увеличение случаев рака легких произошло с запозданием на 15-20 лет. Это позволило медикам предположить причинную взаимосвязь, но этого было недостаточно для убедительности. Например, вместе с увеличением курения, увеличилось пользование телефонами, но мы не считаем, что это приводит к увеличению случаев рака легких. Исследования показали, что люди, которые курят сигареты регулярно, имеют большой риск умереть от рака легких, чем некурящие люди. Исключая эффект загрязнения воздуха в городах, ученые анализировали риск смерти, вызываемой раком легких от плотности курящего населения. В результате была получена высокая положительная корреляция между жителями города и случаями рака легких. Более того, риск возникновения рака легких увеличивался почти линейно с количеством выкуриваемых сигарет в день и медленно уменьшался после прекращения курения, достигая фонового уровня через десять лет. Риск смерти от коронарных заболеваний, как было показано, тоже увеличивается в несколько раз с увеличением потребления табака. Частота смертельных случаев из-за рака легких у мужчин в США увеличилась почти в 20 раз с 1930 по 1965 год, у женщин только в 3 раза. Исследования в 1965 году показали, что максимальный возраст для рака легкого у курящих мужчин составляет 65-75 лет. Частота заболевания у женщин ниже по сравнению с мужчинами. Это заинтересовало нескольких исследователей. Либо женщины более стойкие к воздействию табака, либо теория о том, что табак вызывает заболевания, не верна. Впоследствие поняли, что женщины начинают курить намного позже, чем мужчины. Исследования показали, что эффект у женщин запаздывает на 20 лет по сравнению с мужчинами. Количество заболеваний раком легких у женщин значительно возросло в 1970-1980-е годы. Как результат, к 1990-му году в США смертность среди женщин от рака легких превысила смертность от рака молочной железы. Курение оказывает чрезвычайно губительное воздействие на здоровье человека. Материал для изготовления табачных изделий имеет высокое содержание полициклических ароматических соединений, которые являются мутагенами и канцерогенами. Ариламины также широко распространены и, возможно, увеличивают риск возникновения раковых клеток у курильщиков. Летучие составляющие табачного дыма включают в себя не только нитрозамины, но также и другие токсичные вещества (цианид, формальдегид, акролин, ацетальдегид). Отличительной особенностью табачного дыма является высокое содержание специфических нитрозаминов: никотина и родственных ему алкалоидов: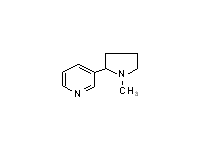 Норникотин
Норникотин 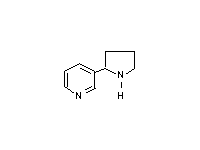 Никотин
Никотин 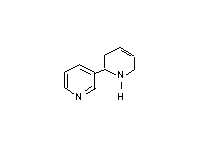 Анатабин После того как эпителий дыхательных путей подвергается воздействию канцерогенов, различные типы клеток способны сформировать опухоли. Аденокарцинома формируется из нескольких типов клеток, включая слизистые, бронхиальные и реснитчатые клетки. Хроническое раздражение курением разрушает эпителиальные клетки трахей и верхних бронхов. Из разнообразия типов раковых клеток, которые образуются в легких, только один найден у курильщиков. Этот вид раковых клеток возникает из маленьких гранул – эндокринных клеток. Все карциномы обычно диагностируются на поздних стадиях, когда они не оперируются и являются фатальными. Ввиду того, что курение в общественных местах запрещается, табачная индустрия придает собое значение продажам бездымного табака, жевательного и нюхательного. Таким образом, потребитель избегает табачного дыма, но, к сожалению, не нитрозаминов алкалоидного происхождения. Исследования показали, что потребители нюхательного табака имеют в 30 раз больший риск образования раковых клеток в ротовой полости, чем люди, не употребляющие табак. Эти исследования обеспечили доказательства того, что нитрозамины, содержащиеся в табаке, являются канцерогенами для человека. Курение вызывает хронические заболевания легких по нескольким путям. При возникновении хронического бронхита, частицы табачного дыма стимулируют секрецию слизи, которая засоряет бронхиальные каналы и ослабляет очистку вдыхаемых газов от токсикантов. Это приводит к спазмам, что вызывает кашель. При возникновении эмфиземы частицы табачного дыма активируют макрофаги, которые начинают секретировать протеазы. Более того, оксиданты в дыме превращают метионин в α1-антитрипсине в сульфоксид, инактивируя, таким образом, этот белок. Результатом является дезорганизация основного слоя, потеря перегородки и уменьшение альвеолярного пространства. Курильщики, которые испытывают недостаток в α1-антитрипсине, заболевают эмфиземой в более раннем возрасте (20-30 лет), чем обычно (50-60 лет). Коварство курения заключается в развитии привычки, виновником которой является никотин. Никотин долгое время был известен в качестве агониста для подкласса адренергического рецептора, но механизм, посредством которого образуется зависимость, еще не ясен. Сегодня уровень никотина в сигаретах жестко лимитируется, так как высокое содержание никотина вызывает тошноту, в то время как небольшое количество может не вызывать зависимость и не способно удовлетворить тягу, когда зависимость уже присутствует. Исследования показывают, что качество табака снижается из-за смол, содержащихся в нем. Также было показано, что для заядлых курильщиков необходима большая доза никотина. Из-за меньшей переносимости женщин существуют специальные легкие марки (например “Virginia Slims”) с пропорционально низким уровнем никотина. Никотиновая зависимость становится такой же сильной, как наркотическая и алкогольная, но в отличие от их вредного воздействия на поведение, данная зависимость не является таковой. При уменьшении влияния никотиновой зависимости увеличивается вес тела, что является фактором, усиливающим привычку. Хорошо известно неблагоприятное влияние курения на репродуктивную способность. При курении табака поглощается большое количество монооксида углерода, который имеет более высокое сродство с гемоглобином, чем кислород. Для некурящих содержание комплекса гемоглобина с монооксидом углерода в норме составляет менее 1% от всего количества гемоглобина. Уровень 5-10% оказывает неблагоприятное воздействие на центральную нервную систему, а также на сердечно-сосудистую систему. Этот уровень легко достижим у курильщиков и может расти до 15% и более. К сожалению, гемоглобин у эмбриона имеет большее сродство с СО, чем гемоглобин взрослого человека. В результате этого возможно возникновение недостатка кислорода, благодаря чему появляются препятствия для нормального развития плода. Дети курящих родителей страдают от увеличения риска респираторных заболеваний и других болезней легких из-за поражающего воздействия курения. Некурящие люди, хронически поглощающие табачный дым, страдают от различных респираторных и аллергических заболеваний. Таким образом, неудивительно, что дети, более восприимчивые к влиянию токсичных веществ, чем взрослые, становятся жертвами своих курящих родителей. Тем не менее, влияние никотина на центральную нервную систему развивающегося плода не было объяснено как результат курения матери в течение беременности. Однако этот факт можно не учитывать, так как никотин-ацетилхолиновые рецепторы были замечены в нейронах в определенных частях мозга. Дети курящих отцов имеют большую вероятность дефектов при рождении, возможно, из-за последствий окислительного разрушения ДНК в сперме. Более того, рак у детей более распространен среди детей курящих родителей. Вероятность возникновения лейкемии, лимфомы и опухолей мозга у таких детей выше в 3-4 раза. Поразительным является совместное действие курения и некоторых других агентов, вызывающих рак. Например, рак пищевода случается у некурящих людей, которые употребляют алкоголь. Курильщики имеют повышенный риск, как и люди, употребляющие большое количество алкоголя. Но у алкоголиков, которые к тому же много курят, риск этого заболевания увеличивается в 100 раз выше. У курильщиков также в значительной степени увеличен риск рака легких при воздействии на них асбестовой пыли. У женщин детородного возраста удвоен риск возникновения болезней сердца, если они принимают оральные контрацептивы. Курение увеличивает этот риск в 10 раз. Мы приводим только малую долю примеров неблагоприятного воздействия от употребления табака. С каждым днем открывается все больше и больше неблагоприятных эффектов. Но так как эти эффекты являются распространенными, они могут быть вызваны другими причинами, не связанными с курением, что усложняет исследования. Однако болезни, вызванные курением, являются столь распространенными, что имеют тенденцию перекрывать другие проблемы. Одной из причин отсутствия многозначительного ответа на эпидемиологию заболеваний, вызванных курением, является то, что табак содержит все наиболее опасные токсиканты.
Анатабин После того как эпителий дыхательных путей подвергается воздействию канцерогенов, различные типы клеток способны сформировать опухоли. Аденокарцинома формируется из нескольких типов клеток, включая слизистые, бронхиальные и реснитчатые клетки. Хроническое раздражение курением разрушает эпителиальные клетки трахей и верхних бронхов. Из разнообразия типов раковых клеток, которые образуются в легких, только один найден у курильщиков. Этот вид раковых клеток возникает из маленьких гранул – эндокринных клеток. Все карциномы обычно диагностируются на поздних стадиях, когда они не оперируются и являются фатальными. Ввиду того, что курение в общественных местах запрещается, табачная индустрия придает собое значение продажам бездымного табака, жевательного и нюхательного. Таким образом, потребитель избегает табачного дыма, но, к сожалению, не нитрозаминов алкалоидного происхождения. Исследования показали, что потребители нюхательного табака имеют в 30 раз больший риск образования раковых клеток в ротовой полости, чем люди, не употребляющие табак. Эти исследования обеспечили доказательства того, что нитрозамины, содержащиеся в табаке, являются канцерогенами для человека. Курение вызывает хронические заболевания легких по нескольким путям. При возникновении хронического бронхита, частицы табачного дыма стимулируют секрецию слизи, которая засоряет бронхиальные каналы и ослабляет очистку вдыхаемых газов от токсикантов. Это приводит к спазмам, что вызывает кашель. При возникновении эмфиземы частицы табачного дыма активируют макрофаги, которые начинают секретировать протеазы. Более того, оксиданты в дыме превращают метионин в α1-антитрипсине в сульфоксид, инактивируя, таким образом, этот белок. Результатом является дезорганизация основного слоя, потеря перегородки и уменьшение альвеолярного пространства. Курильщики, которые испытывают недостаток в α1-антитрипсине, заболевают эмфиземой в более раннем возрасте (20-30 лет), чем обычно (50-60 лет). Коварство курения заключается в развитии привычки, виновником которой является никотин. Никотин долгое время был известен в качестве агониста для подкласса адренергического рецептора, но механизм, посредством которого образуется зависимость, еще не ясен. Сегодня уровень никотина в сигаретах жестко лимитируется, так как высокое содержание никотина вызывает тошноту, в то время как небольшое количество может не вызывать зависимость и не способно удовлетворить тягу, когда зависимость уже присутствует. Исследования показывают, что качество табака снижается из-за смол, содержащихся в нем. Также было показано, что для заядлых курильщиков необходима большая доза никотина. Из-за меньшей переносимости женщин существуют специальные легкие марки (например “Virginia Slims”) с пропорционально низким уровнем никотина. Никотиновая зависимость становится такой же сильной, как наркотическая и алкогольная, но в отличие от их вредного воздействия на поведение, данная зависимость не является таковой. При уменьшении влияния никотиновой зависимости увеличивается вес тела, что является фактором, усиливающим привычку. Хорошо известно неблагоприятное влияние курения на репродуктивную способность. При курении табака поглощается большое количество монооксида углерода, который имеет более высокое сродство с гемоглобином, чем кислород. Для некурящих содержание комплекса гемоглобина с монооксидом углерода в норме составляет менее 1% от всего количества гемоглобина. Уровень 5-10% оказывает неблагоприятное воздействие на центральную нервную систему, а также на сердечно-сосудистую систему. Этот уровень легко достижим у курильщиков и может расти до 15% и более. К сожалению, гемоглобин у эмбриона имеет большее сродство с СО, чем гемоглобин взрослого человека. В результате этого возможно возникновение недостатка кислорода, благодаря чему появляются препятствия для нормального развития плода. Дети курящих родителей страдают от увеличения риска респираторных заболеваний и других болезней легких из-за поражающего воздействия курения. Некурящие люди, хронически поглощающие табачный дым, страдают от различных респираторных и аллергических заболеваний. Таким образом, неудивительно, что дети, более восприимчивые к влиянию токсичных веществ, чем взрослые, становятся жертвами своих курящих родителей. Тем не менее, влияние никотина на центральную нервную систему развивающегося плода не было объяснено как результат курения матери в течение беременности. Однако этот факт можно не учитывать, так как никотин-ацетилхолиновые рецепторы были замечены в нейронах в определенных частях мозга. Дети курящих отцов имеют большую вероятность дефектов при рождении, возможно, из-за последствий окислительного разрушения ДНК в сперме. Более того, рак у детей более распространен среди детей курящих родителей. Вероятность возникновения лейкемии, лимфомы и опухолей мозга у таких детей выше в 3-4 раза. Поразительным является совместное действие курения и некоторых других агентов, вызывающих рак. Например, рак пищевода случается у некурящих людей, которые употребляют алкоголь. Курильщики имеют повышенный риск, как и люди, употребляющие большое количество алкоголя. Но у алкоголиков, которые к тому же много курят, риск этого заболевания увеличивается в 100 раз выше. У курильщиков также в значительной степени увеличен риск рака легких при воздействии на них асбестовой пыли. У женщин детородного возраста удвоен риск возникновения болезней сердца, если они принимают оральные контрацептивы. Курение увеличивает этот риск в 10 раз. Мы приводим только малую долю примеров неблагоприятного воздействия от употребления табака. С каждым днем открывается все больше и больше неблагоприятных эффектов. Но так как эти эффекты являются распространенными, они могут быть вызваны другими причинами, не связанными с курением, что усложняет исследования. Однако болезни, вызванные курением, являются столь распространенными, что имеют тенденцию перекрывать другие проблемы. Одной из причин отсутствия многозначительного ответа на эпидемиологию заболеваний, вызванных курением, является то, что табак содержит все наиболее опасные токсиканты.
Дата добавления: 2019-09-30; просмотров: 1387;











