МЕТОДЫ АНАЛИЗА ГЕНОВ
Методы рекомбинантной ДНК создали предпосылку для разработки новых методов молекулярной диагностики с большей разрешающей способностью и, следовательно, более точных и информативных. Об абсолютном преимуществе молекулярного подхода говорит тот факт, что в отличие от других методов диагностики, ограниченных выявлением исключительно фенотипических аспектов, анализ ДНК, направленный непосредственно на изучение генотипа, является единственным методом, изучающим первичные нарушения (мутации), то есть именно первопричину возникновения болезней.
Технология рекомбинантной ДНК позволяет определить нормальные гены и/или мутантные их варианты, установить носителей мутантного гена, диагностировать наследственную патологию до рождения ребенка или в предсимптоматической стадии, а в ближайшем будущем проводить и генную терапию.
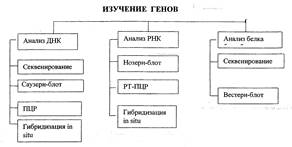
Молекулярное изучение генов может осуществляться многими путями в зависимости от поставленной цели:
1. секвестрование ДНКдля определения первичной структуры гена;
2. метод Саузерн-блот для определения позиции гена в геноме;
3. метод Нозерн-блотдля определения экспрессии генов (анализ мРНК);
4. метод Вестерн-блотдля определения белкового продукта гена;
5. метод ПЦРдля специфичной амплификации фрагментов ДНК.
В лабораториях молекулярной биологии используются различные варианты перечисленных методов.
Все перечисленные методы основаны на различных принципах манипулирования нуклеиновыми кислотами:
- специфическая рестрикция ДНК сцелью получения интересующего фрагмента;
- идентификация фрагментов ДНК или РНК е помощью специальных зондов, комплементарных искомому участку;
- идентификация нормальных и патологических генов путем ПЦР - специфическая реакция отбора праймеров, комплементарных гену/последовательности;
- визуализация необходимого фрагмента по результатам электрофореза и специфического маркирования ДНК/РНК с использованием компьютерных программ чтения и анализа результатов;
- комплексная интерпретация результатов в зависимости от использованного метода.
| Для разделения полученных фрагментов ДНК применяется электрофорез макромолекул в агарозном или полиакриламидном геле. Будучи отрицательно заряжены, фрагменты молекул нуклеиновых кислот в электрическом поле перемещаются с разной скоростью в зависимости от молекулярной массы. Более короткие фрагменты перемещаются быстрее, в то время, как более длинные - медленнее. Для определения размеров фрагментов в геле, одновременно с интересующими фрагментами помещаются на соседние дорожки и фрагменты - маркеры длины. Молекулы нуклеиновых кислот могут быть обнаружены в геле при окраске флуоресцентным красителем или по радиоактивной метке. В случае радиоактивного мечения, фрагменты определяются с помощью авторадиографии, которая заключается в накладывании на гель светочувствительной пленки. |
Секвенирование ДНК
Секвенирование заключается в определении последовательности нуклеотидов (азотистых оснований) в исследуемом фрагменте ДНК. Анализ последовательностей нуклеотидов ДНК может быть осуществлен двумя путями: 1) химическим (метод Максима - Гильберта), при котором используются химические реакции последовательного расщепления фрагмента ДНК на отдельные нуклеотиды, однако этот метод очень трудоемкий, сложный и в последнее время не используется; 2) ферментативным (метод Сэнгера), при котором фрагменты ДНК синтезируются in vitro таким образом, что реакция завершается в положении, соответствующем определенному основанию. Для определения последовательности нуклеотидов любым из этих методов, ДНК подвергается серии из 4-х отдельных реакций, каждая из которых является специфической для одного из 4-х видов нуклеотидов. При одновременном электрофорезе продукты реакции на 4-х соседних дорожках будут мигрировать по ним с разной скоростью. Размер синтезированных фрагментов можно определить, а, следовательно, может быть определен и порядок нуклеотидов в
ДНК.
Метод Сэнгера (дидеокси) использует ферментативный синтез одной цепи, комплементарной клонированной матрице. В ходе данного процесса синтез ДНК останавливается добавлением одного из дидезоксинуклеозидтрифосфата, аналога нуклеотидов. Дидезоксинуклеозидтрифосфат содержит в позиции 3' не группу ОН, а Н-группу, которая препятствует полимеризации нуклеотидов. Используя четыре разных аналога дидезокси в процессе синтеза новой цепи ДНК, можно, таким образом, определить каждый нуклеотид матричной цепи. Электрофорез полученных фрагментов позволяет определить порядок нуклеотидов ДНК.
В последние годы применяются методы автоматического секвенирования.
С целью диагностики носителей мутантного гена результат секвенирования сравнивают с первичной структурой гена. К сожалению, не для всех генов человека к настоящему моменту известны последовательности нуклеотидов, поэтому применяются и непрямые методы диагностики: сцепление с близлежащими ДНК-маркерами (определение гйпервариабельных мини- и микросателлитных повторов), определение характерных для данного гена полиморфных сайтов рестрикции, гибридизация со специфическими зондами и др.

Метод Саузерн-блот
Метод основан на специфическом анализе определенных фрагментов геномной ДНК/гена, полученных путем рестрикции ДНК одной или несколькими рестриктазами. Ферменты рестрикции действуют не случайно, а разрезают ДНК в строго определенных местах, поэтому в результате действия одной рестриктазой получают двухцепочечные фрагменты ДНК разной длины (количество фрагментов и их длина специфичны для данной рестриктазы). Учитывая полиморфизм ДНК/генов, обусловленный точечными мутациями, длины фрагментов специфичны и неодинаковы у разных индивидов (полиморфизм длины рестрикционных фрагментов - ПДРФ).
Для анализа ПДРФ ряда генов необходимо знать специфическую локализацию сайтов рестрикции. Эта информация может быть полезна для сравнения нормальных и мутантных генов для раннего выявления носителей патологических генов. На данном принципе основан метод Саузерн-блот, который позволяет идентифицировать интересующий фрагмент в смеси из тысячи разных фрагментов, полученных в результате рестрикции геномной ДНК. Идентификация необходимого фрагмента осуществляется на основе гибридизации ДНК-мишени с комплементарным меченым зондом.
Метод Саузерн-блота состоит из последовательности следующих этапов:
(1) выделение высокомолекулярной геномной ДНК из клетки;
(2) ферментативное расщепление ДНК разными рестриктазами с образованием фрагментов разной длины;
(3) разделение рестрикционных фрагментов в агарозном геле;
(4) денатурация фрагментов ДНК щелочным раствором;
(5) нейтрализация геля буферным раствором;
(6) капиллярный перенос фрагментов на нейлоновый или нитроцеллюлезный фильтр;
(7) гибридизация с одноцепочечными радиоактивными зондами;
(8) авторадиография для выявления гибридов: исследуемая ДНК / зонд.
Перенос фрагментов на нитроцеллюлезный фильтр - блоттинг - предложил Эдвард Саузерн.

В результате анализа полученного материала можно определить наличие или отсутствие некоторых сайтов рестрикции, характерных для изучаемого гена, которые ассоциируются с определенными мутациями. Различные варианты расположения сайтов рестрикции в ДНК у двух разных людей называют Полиморфизмом Длины Рестрикционных Фрагментов (ПДРФ).Этот полиморфизм используется как генетический маркер в изучений генотипа.
Практическое применение метода Саузерн-блот:
- выявление точечных мутаций, затрагивающих сайты рестрикции (появляются новые или исчезают старые сайты рестрикции) по изменению количества и длины фрагментов рестрикции;
- выявление мутаций типа делении, дупликации, инсерции более длинных фрагментов (50-100 п.н.) по изменению длины фрагментов рестрикции.
Это позволяет проводить пренатальную и пресимптоматическую диагностику патологических мутаций и выявление гетерозиготных носителей мутантных генов.
Метод Саузерн-блот имеет, однако, следующие недостатки: (1) не позволяет выявить точечные мутации, не затрагивающие сайтов рестрикции (в пределах фрагмента рестрикции); (2) является достаточно трудоемким, сложным и дорогим методом.
Метод Нозерн-блот
Метод состоит в переносе разделенных молекул РНК на нейлоновые или нитроцеллюлезные фильтры с последующей гибридизацией с мечеными зондами. Метод схож с методом Саузерн-блот, за исключением того, что выделенные и очищенные мРНК не подвергают рестрикции, а электрофорез не происходит в условиях денатурации.
Метод Нозерн-блот позволяет идентифицировать транскрипты анализируемых генов, количества мРНК, их размеры.
Метод Бестерн-блот
Этот метод заключается в определении специфического белка из смеси клеточных белков. Для этого белки разделяют электрофорезом в условиях денатурации, в присутствии додецилсульфатa Na. Белки, разделённые по молекулярной массе, переносят на плотный фильтр и обрабатывают специфическими мечеными антителами. Этот метод позволяет определить наличие или отсутствие белка, его размер и скорость экспрессии гена по количеству синтезированного белка.
Дата добавления: 2017-01-16; просмотров: 3652;











