Внутренняя энергия газа с учётом числа степеней свободы.
Виды термодинамических систем. Термодинамические параметры.
Термодинамика – это раздел физики, в котором изучаются закономерности превращений энергии, обусловленных тепловым движением молекул.
Для изучения термодинамики необходимо усвоить ряд определений.
Термодинамической системой называется совокупность тел, которые могут обмениваться энергией и веществом, как между собой, так и с внешней средой.
Под внешней средой подразумеваются тела, находящиеся вне границ данной системы.
Система, не обменивающаяся с внешней средой ни веществом, ни энергией называется изолированной.
Система, обменивающаяся только энергией, называется закрытой или замкнутой.
Система, осуществляющая обмен с окружающей средой, как веществом, так и энергией называется открытой.
Состояние термодинамической системы определяется величинами, называемыми параметрами состояния к которым относятся давление р, удельный объём Vуд. и термодинамическая температура T.
Давление – это величина, равная отношению модуля силы, действующей перпендикулярно поверхности к её площади: 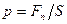 . (1)
. (1)
Удельный объём представляет собой пространство, занимаемое единицей массы вещества
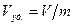 . (2)
. (2)
В термодинамике температура является величиной, характеризующей направление теплообмена между телами. Для выражения температуры используется абсолютная шкала температур, предложенная Кельвином, в которой
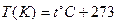 . (3)
. (3)
Состояние системы с неизменными термодинамическими параметрами называют равновесным, если оно не обусловлено воздействием внешних по отношению к системе тел.
Отличительной особенностью равновесного состояния является то, что оно может сохраняться сколь угодно долго в отсутствие внешнего воздействия.
Переход системы из одного стационарного состояния в другое называют термодинамическим процессом.
Энергетической характеристикой термодинамических процессов является внутренняя энергия.
Внутренней энергией называется сумма кинетической энергии хаотического движения частиц и потенциальной энергии их взаимодействия:
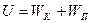 .
.
В случае идеального газа потенциальная энергия равна нулю W = 0, поэтому:
U = WK.
Кинетическую энергию можно выразить как среднюю энергию одной молекулы на их количество
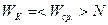 ,
,
которые можно определить из известных уравнений
 и
и 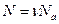 .
.
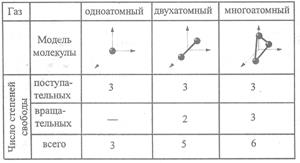
Таблица 1 Таким образом, внутренняя энергия идеального газа будет равна:
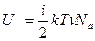 ,
,
или с учётом 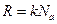 ,
,
 получаем:
получаем: 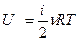 , (4)
, (4)
для идеального газа i = 3, для двухатомного газа i = 5, для трёх и более атомов i = 6 (таблица 1).
Дата добавления: 2017-01-16; просмотров: 1775;











