Законы Бойля-Мариотта, Гей-Люссака, Шарля и их графическое представление.
 Вещество, с точки зрения молекулярной физики, характеризуется следующими величинами: массой, объёмом, давлением и температурой. С помощью них можно определить состояние вещества, поэтому они так и называются – параметры состояния.
Вещество, с точки зрения молекулярной физики, характеризуется следующими величинами: массой, объёмом, давлением и температурой. С помощью них можно определить состояние вещества, поэтому они так и называются – параметры состояния.
Изменение параметров состояния приводит к возникновению в газах термодинамических процессов.
Процессы, происходящие при одном неизменном параметре, называются изопроцессами.
Процесс, происходящий в газе при постоянной температуре, называется изотермическим.
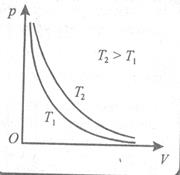
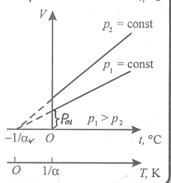 Рис.2 Изотермический процесс характеризуется законом Бойля (англ.) – Мариотта (фр.) 1667г. для данной массы газа при постоянной температуре давление газа меняется обратно пропорционально объёму:
Рис.2 Изотермический процесс характеризуется законом Бойля (англ.) – Мариотта (фр.) 1667г. для данной массы газа при постоянной температуре давление газа меняется обратно пропорционально объёму:

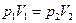 , или
, или 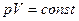 . (7)
. (7)
Графически данная зависимость изображается гиперболой (рис.2), которая называется изотермой.
Процесс, происходящий в газе при постоянном давлении, называется изобарным.
Изобарные процессы подчиняются закону Л. Гей- Люссака (фр.)
1802г.: для данной массы газа при постоянном давлении, объём газа прямопропорционален его температуре

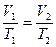 , или
, или 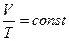 . (8)
. (8)
Рис.3Графическое изображение изобарного процесса представлено на рис.3 и выражается функцией
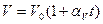 ,
,
где V0 – объём газа при 0ºС, 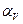 - коэффициент объёмного расширения газа.
- коэффициент объёмного расширения газа.
Процесс в газе, происходящий при постоянном объёме 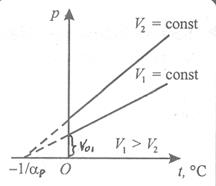 называется изохорным.
называется изохорным.
Изохорный процесс характеризуется законом Шарля:
для данной массы газа при постоянном объёме давление газа изменяется прямо пропорционально температуре

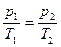 , или
, или 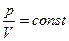 . (9)
. (9)
Функциональная зависимость V(T) представлена на рис.4 и выражается формулой
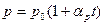 , где
, где
Рис.4 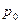 - давление при 0º С,
- давление при 0º С, 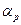 - термический коэффициент давления.
- термический коэффициент давления.
Дата добавления: 2017-01-16; просмотров: 2418;











