Законы газового состояния. Определение молярных масс газообразных веществ
Три параметра – объем V, давление P и температура T (T=273+t) – определяет физическое состояние газа. Давление 1,013∙105Па (760 мм рт. ст.) и температура 273 К или 0оС называют нормальными условиями состояния газа, что в буквенных обозначениях этих величин указывается индексом: Po, To, to. Объем газа при н.у. – Vo.
Закон Бойля – Мариотта. При постоянной температуре объем данной массы газа изменяется обратно пропорционально давлению:
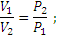
или V1 P1= V2 P2=V3P3…, т.е. V∙P=const.
Закон Гей-Люссака. При постоянном давлении объем данной массы газа меняется прямо пропорционально абсолютной температуре
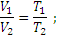
При постоянном объеме:
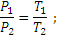
Уравнение Менделеева – Клапейрона. Объединение законов Бойля, Мариотта и Гей-Люссака дает уравнение состояния газа
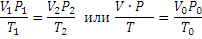
если одно из состояний является нормальным. Для любого газа количеством вещества 1 моль величина 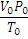 постоянна и одинакова, поэтому её называют универсальной газовой постоянной R. Если
постоянна и одинакова, поэтому её называют универсальной газовой постоянной R. Если 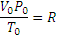 , то VP=RT, а для газа количеством вещества n моль Vp=nRT. Так как n равно отношению массы вещества к его молярной массе, то
, то VP=RT, а для газа количеством вещества n моль Vp=nRT. Так как n равно отношению массы вещества к его молярной массе, то 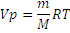 – это равенство и является урав-нением Менделеева – Клапейрона в окончательном виде. Числовые значения универсальной газовой постоянной зависят от того, в каких единицах выражены объем и давление газа. Так в системе СИ единица объема – кубический метр, а единица давления – паскаль (Па), т.е. сила в 1 ньютон, приходящаяся 1м2 площади (Н/м2). Ньютон (Н) – сила сообщающая массе в кг ускорение в 1 м/с. Джоуль – работа силы в 1 ньютон на расстоянии в 1м. Подставляя соответствующие значения в формулу
– это равенство и является урав-нением Менделеева – Клапейрона в окончательном виде. Числовые значения универсальной газовой постоянной зависят от того, в каких единицах выражены объем и давление газа. Так в системе СИ единица объема – кубический метр, а единица давления – паскаль (Па), т.е. сила в 1 ньютон, приходящаяся 1м2 площади (Н/м2). Ньютон (Н) – сила сообщающая массе в кг ускорение в 1 м/с. Джоуль – работа силы в 1 ньютон на расстоянии в 1м. Подставляя соответствующие значения в формулу 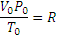 получим
получим
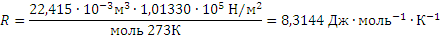
Если объем газа измерен в литрах, а давление газа в мегапаскалях (МПа=106Па), то R=0,083л∙МПа∙моль-1∙К-1. В расчетах обычно используют числа, имеющие три значащие цифры, что дает вполне достаточную точность: 22,4910-3 м3, 22,4 л, 273 К, 8,31 Дж∙моль-1∙К-1.
Согласно закону Авогадро, в равных объемах любых газов, взятых при одной и той же температуре и одинаковом давлении, содержится одинаковое число молекул.
Иными словами, одно и то же число молекул любого газа занимает при одинаковых условиях один и тот же объем. Вместе с тем 1 моль любого газа содержит одинаковое число молекул. Следовательно, при одинаковых условиях 1 моль любого газа занимает один и тот же объем. Этот объем называется мольным объемом газа и при нормальных условиях (00С, давление 101,325 кПа) равен 22,4 л.
Пример 1.Определить объём, занимаемый 5,25 г азота при 260С и давлении 98,9 кПа (742 мм рт.ст.).
Решение. Зная мольный объём и мольную массу (28,0 г/моль) азота, находим объём, который будут занимать 5,25 г азота при нормальных условиях:
28,0 г азота занимают объём 22,4л
5,25 г азота занимают объём VO ,
откуда VO = 5,25∙22,4/ 28,0 = 4,20 л
Затем приводим полученный объём к указанным в задаче условиям:
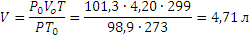
Пример 2.При250С и давлении 99,3 кПа (745 мм рт.ст.) некоторое количество газа занимает объём 152 мл. Найти, какой объём займет это же количество газа при 00С и давлении101,33 кПа.
Решение. Подставляя данные задачи в последнее уравнение, получаем:
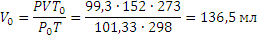
Пример 3.Некоторый газ массой 5,6 г занимает объём 4,84 л притемпературе 170С и давлении 0,997∙105 Па. Чему равна относительная молекулярная масса этого газа?
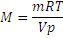 Решение. Из уравнения Менделеева-Клайперона ,откуда
Решение. Из уравнения Менделеева-Клайперона ,откуда
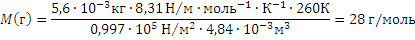
Так как числовое значение молярной массы, выраженной в г/моль, равно относительной молекулярной массе, т.е. {M}=Mr , то Mr = 28.
Дата добавления: 2019-09-30; просмотров: 652;











