Гетерогенный катализ
Основным недостатком гомогенного катализа является трудность выделения катализатора из конечной реакционной смеси, в результате чего часть катализатора теряется безвозвратно, с продукт загрязняется им. Поэтому значительно большее распространение получил гетерогенный катализ.
По фазовому признаку известны различные виды гетерогенного катализа: жидкие катализаторы, ускоряющие реакции между несмешивающимися жидкостями (или жидкостями и газами) и твердые катализаторы, ускоряющие реакции между жидкостями или газами. Большинство каталитических реакций - это реакции газов с участием твердых катализаторов. Из существующих теорий катализа общим для всех теорий является образование на поверхности твердого катализатора промежуточного соединения адсорбционного типа с участием электронов катализатора.
Катализаторы, как правило, представляют собой пористые твердые тела, имеющие высокоразвитую внутреннюю поверхность. Весь каталитический процесс на твердом пористом катализаторе можно представить в виде пяти самостоятельных стадий:
1) Диффузия реагирующих веществ из потока к поверхности зерна катализатора и внутри пор, имеющихся в зерне.
2) Активированная адсорбция (хемосорбция) на поверхности катализатора с образованием промежуточных поверхностных соединений реагент - катализатор.
3) Перегруппировка атомов с образованием промежуточного соединения продукт – катализатор.
4) Десорбция продукта с поверхности катализатора.
5) Диффузия продукта с поверхности катализатора сначала внутри пор, а затем с поверхности зерна в общий поток.
Общая скорость суммарного каталитического процесса лимитируется самой медленной из стадий. Если этой стадией является один из диффузионных этапов, то катализ проходит в диффузионной области. Причем различают внешне- и внутридиффузионные области. Если медленными являются 2, 3 или 4 стадия, то процесс идет в кинетической области.
Общее уравнение скорости каталитического процесса, протекающего в каталитической области,
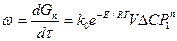 ,
,
где 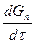 - приращение количества продукта во времени;
- приращение количества продукта во времени;
k0 – предэкспоненциальный множитель в уравнении Аррениуса;
V – насыпной объем катализатора;
е – основной натуральный логарифм;
ΔС – движущая сила процесса при атмосферном давлении;
Р1 – безразмерное давление, т. е. отношение действительного давления к атмосферному;
n – порядок реакции.
В кинетической области протекают процессы на малоактивных катализаторах с мелкими размерами зерен и крупными порами при турбулентном режиме потока реагентов и невысоких температурах.
Если процесс идет во внешнедиффузионной области, то скорость определяется коэффициентом диффузии реагентов и продуктов реакции. По закону Фика
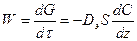 ,
,
где Dэ – эффективный коэффициент диффузии;
S – свободная поверхность зерен катализатора;
Z – направление, перпендикулярное поверхности.
Во внешнедиффузионной области проходят процессы на активных катализаторах. Для ускорения процесса применяют высокие скорости потока.
Во внутридиффузионной области общая скорость каталитического процесса лимитируется скоростью диффузии реагентов и продуктов реакции в порах зерен катализатора. Каталитические процессы во внутридиффузионной области можно ускорить уменьшением зерен катализатора и увеличением радиуса пор, но при этом сокращается их количество и соответственно поверхность.
Важнейшими характеристиками катализатора являются:
1. Температура зажигания– минимальная температура реагирующей смеси, при которой процесс начинает протекать с достаточной для практических целей скоростью. Чем активнее катализатор, тем ниже температура зажигания. Это очень важно при проведении экзотермических обратимых реакций типа A = R + Q , так как можно повысить степень превращения.
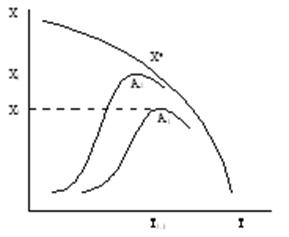
Зависимость степени превращения Х экзотермической обратимой реакции от температуры для катализаторов различной активности А2>А1
При этом можно снизить предварительный подогрев реагентов.
2. Время контактирования – время соприкосновения реагирующих веществ с катализатором. Определяется
 ,
,
где Vсв – свободный объем катализатора, м3;
Vсм – объем реагирующей смеси, проходящей через катализатор, м3/с.
Чаще всего пользуются фиктивным временем контактирования
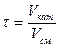 ,
,
где Vкат – объем катализатора, м3.
Величина, обратная времени контакта, называется объемной скоростью – объем реакционной смеси, проходящей через единицу времени.
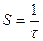 ,
, 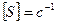
При увеличении объемной скорости обычно снижается степень превращения, однако при этом возрастает интенсивность работы аппарата, т. е. увеличивается количество целевого продукта, получаемого с единицы объема катализатора в единицу времени. Это объясняется тем, что при увеличении скорости потока реакционная смесь находится далеко от состояния равновесия и движущая сила ΔС велика.
В качестве примера приведем данные о влиянии объемной скорости на интенсивность каталитического процесса синтеза аммиака
N2 + 3H2 = 2NH3.
| S, с-1 | % NH3 в газовой смеси | Интенсивность катализатора |
| 0 (равновесие) | ------ | |
Из этих данных следует, что при увеличении скорости в 5 раз содержание аммиака падает в 1,5 раза, а интенсивность процесса возрастает в 3 раза.
Интенсивность катализатора выражают в виде уравнения
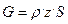 ,
,
где G – производительность катализатора, кг ч-1 м-3;
z – мольная доля целевого продукта в газовой смеси;
S – объемная скорость, ч-1;
ρ – плотность реагента при нормальных условиях, кг/м3.
Отравление катализатора – это частичная потеря активности в результате действия небольшого количества веществ, называемых контактными ядами. Оно вызывается в результате химического взаимодействия яда с катализатором с образованием каталитически неактивных соединений.
Отравление может быть обратимым и необратимым. При обратимом отравлении активность катализатора снижается лишь во время присутствия яда в поступающей смеси. При поступлении чистой смеси соединения яда с катализатором разлагаются, адсорбированный яд улетучивается и отгоняется вместе с продуктами реакции.
Необратимое отравление является постоянным. Отравленный катализатор необходимо заменять новым, или же регенерировать старый. Наиболее чувствительны к ядам металлические катализаторы, особенно благородные металлы. Для платинового катализатора, применяемого в процессах окисления, ядами являются H2S, соединения мышьяка, ионы металлов Pb+2 , Cu++ , Sn+ , Fe+. К ядам катализаторов гидрирования относятся H2S, PH3, NH3, O2.
Активность катализатора может падать при спекании (уменьшается поверхность), при отложении на их поверхности примесей, например кокса.
Дата добавления: 2017-01-08; просмотров: 2198;











