Изомерия моносахаров.
(Самостоятельная работа студентов)
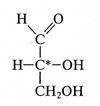
Оптическая изомерия моносахаридов. Характерной особенностью структуры моносахаридов является наличие в молекулах асимметрических (т.е. имеющих четыре различных заместителя) атомов углерода. Асимметрические атомы углерода представляют собой центры хиральности молекулы. Следствие хиральности молекулы — явление оптической изомерии, или энантиомерии, которое выражается в способности соединения вращать плоскость поляризованного света в противоположные стороны. Соединение с п асимметрическими атомами углерода может существовать в виде 2n изомеров. В соединениях с одинаковыми асимметрическими атомами углерода число оптических изомеров уменьшается вследствие существования мезо-форм. Мезо-соединения оптически неактивны из-за «внутренней компенсации» знака вращения. Примером мезо-соединения является D-ксилит.
Оптические изомеры, относящиеся друг к другу как несимметричный предмет к своему зеркальному отображению, называют энантиомерами, или оптическими антиподами. Энантиомеры отличаются друг от друга конфигурацией всех центров хиральности и образуют правовращающую D-форму (лат. dexter— правый), или (+) - форму, и левовращающую L-форму (лат. laevus — левый), или (-) - форму, — стереохимические ряды моносахаридов. Изомеры, отличающиеся конфигурацией только части центров хиральности и не являющиеся оптическими антиподами, называют диастереомерами. Пару диастереомеров, отличающихся конфигурацией только одного асимметрического атома углерода, называют эпимерами.
Э.Фишер и русский химик М. Розанов приписывали условно конфигурации D и L - глицеральдегиду; как показали дальнейшие экспериментальные исследования, эти предположения совпали с истинными конфигурациями. Таким образом,в качестве стандарта для определения принадлежности соединения стереохимическому D- или L-ряду была принята конфигурация асимметрического атома в простейшей триозе — D-глицериновом альдегиде (асимметрический атом углерода обозначен звездочкой):
Принадлежность соединения стереохимическому ряду определяет конфигурация асимметрического атома углерода с наибольшим номером (в случае глюкозы — атома С5). Если она совпадает с конфигурацией асимметрического атома углерода D-глицеринового альдегида, то соединение относят к D-ряду, если не совпадает — к L-ряду. В соответствии с R, S - номенклатурой D - конфигурация соответствует R - глицеральдегиду, a L - S- глицеральдегиду.
Установлено, что все природные монозы относятся к D-ряду, однако среди них имеются как лево- (-), так правовращающие (+) соединения. Так D- глюкоза является правовращающим энантиомером, а D- фруктоза – левовращающим энантиомером.
Цикло-оксо-таутомерия моносахаридов. Моносахариды могут существовать в циклической форме. Впервые предположение о циклическом строении глюкозы было высказано нашим соотечественником А.А. Колли (1870), а затем развито и дополнено немецким ученым Б. Толленсом (1883).
За счет подвижности связей С-С пяти- и шестиуглеродные цепи углеводов могут иметь клешневидную конфигурацию и поэтому является возможным сближение двух функциональных групп - альдегидной (или кетонной) и гидроксильной групп у С4 или С5. За счет их внутримолекулярного взаимодействия друг с другом происходит замыкание цикла, и образуется циклическая структура углеводов ( циклический полуацеталь). Образование циклических форм на примере глюкозы показано на ниже приведенной схеме:
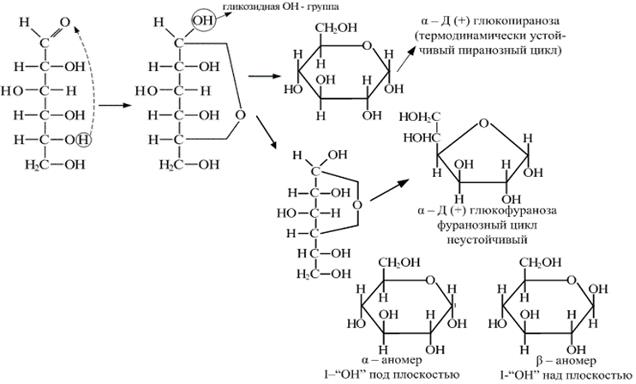
Таким образом, образование полуацеталей можно рассматривать как внутримолекулярную реакцию AN, в результате которой образуются наиболее устойчивые шестичленные циклы (пиранозные) и пятичленные циклы (фуранозные).
В твердом состоянии и в водном растворе моносахариды преимущественно существуют в виде циклических полуацеталей.
Как показали исследования, в растворе устанавливается таутомерное равновесие между открытой (оксо-формой) и циклической формой моносахарида, причем циклическая форма значительно преобладает (более 99,9 % в равновесной смеси). Данный процесс схематически показан на примере фруктозы:

Для изображения на плоскости пространственной структуры соединений в открытой форме используют проекционные формулы Фишера, а для изображения на плоскости пространственной структуры циклических соединений применяют проекционные формулы Хоуорса (Хеуорса):
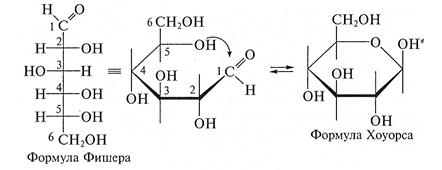
При этом руководствуются следующими правилами: цикл изображают плоским; заместители, находящиеся в оксо-форме справа, изображают под плоскостью цикла, а находящиеся слева — над плоскостью цикла; атомы водорода связей С—Н могут быть не показаны.
В циклической форме появляется дополнительный по сравнению с открытой формой асимметрический атом углерода (центр хиральности): атом С1, в альдозах или атом С2 в кетозах, называемый аномерныматомом углерода, и дополнительная группа —ОН, называемая полуацеталънымгидроксилом (в формуле Хоуорса показана звездочкой *). Если конфигурация аномерного атома углерода совпадает с конфигурацией атома, определяющего принадлежность соединения стереохимическому ряду, его называют α-аномером, если не совпадает — β-аномером.
Таким образом, α- и β-аномеры моноз можно рассматривать как изомеры положения полуацетального гидроксила. Переход аномерных форм α ↔ β осуществляется только через открытую оксо-форму: α-форма ↔ оксо-форма ↔ β-форма
Аналогично устанавливается равновесие в растворе между пиранозными и фуранозными формами. Преобладание α- или β-аномера зависит от природы монозы, растворителя, концентрации и других внешних условий. Равновесие между всеми формами является, таким образом, динамическим. Так, если какой-либо аномер глюкозы растворить в воде, он постепенно превращается в другой аномер, пока не образуется равновесная смесь двух аномеров, в которой также содержится очень небольшое количество открытой формы. Этот переход сопровождается изменением оптического вращения раствора. Такое явление называют мутаротацией(аномеризацией) моносахаридов. Равновесная смесь, образующаяся в результате мутаротации как α-, так и β-D-глюкопираноз, содержит 36 % a-изомера и 64 % β-формы. Доля оксо-формы в равновесной смеси невелика (при рН 6,9 равновесная смесь D-глюкозы содержит лишь малую часть альдегидной формы). Поэтому монозы не дают характерного для альдегидов окрашивания в реакции с фуксиносернистой кислотой и не реагируют с гидросульфитом натрия. Мутаротация катализируется кислотами и основаниями. В твердом состоянии монозы находятся исключительно в циклической форме.
§9.1.3. Химические свойства моносахаридов.
В химическом отношении монозы сочетают в себе свойства многоатомных спиртов, карбонильных соединений и полуацеталей.
1.Образование гликозидов. Для циклических форм моноз наиболее характерны реакции с участием гидроксильной группы. Наиболее химически активна полуацетальная гидроксильная группа.
Моносахариды взаимодействуют со спиртами с образованием О-гликозидов. Так, при пропускании через раствор β-D-глюкозы в этаноле газообразного хлороводорода происходит образование смеси α- и β-аномеров — этил-α,β-D-глюкопиранозы:
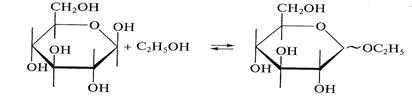
Молекула этанола выступает в данной реакции в роли нуклеофила. Аналогично монозы взаимодействуют с аминами и их производными с образованием N-гликозидов:
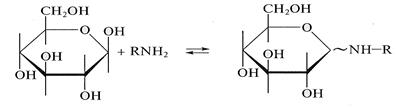
Гликозиды представляют собой продукты конденсации циклических форм моносахаридов со спиртами и аминами с образованием гликозидной связи. Гликозиды легко подвергаются гидролизу в кислой среде. По типу О-гликозидов образуются ди- и полисахариды, а по типу N-гликозидов— нуклеозиды — структурные компоненты нуклеиновых кислот. Гликозиды играют чрезвычайно важную роль в биохимических процессах, в частности в процессах дыхания и фотосинтеза. Важнейший из гликозидов — аденозинтрифосфат (АТФ), являющийся сложным эфиром фосфорной кислоты и аденозина — нуклеозида, являющегося продуктом конденсации аденина с рибозой. Фосфатные группы АТФ выполняют роль своеобразного энергетического депо; при их гидролизе выделяется энергия, необходимая клеткам для мышечного сокращения.
Образование сложных эфиров. При взаимодействии с кислотами и их ангидридами монозы образуют сложные эфиры. Так, при взаимодействии глюкозы с уксусным ангидридом образуется пентаацетилглюкоза. Биологически важный пример реакции данного типа — реакция фосфорилирования глюкозы — ферментативное взаимодействие глюкозы с аденозинтрифосфорной кислотой с образованием глюкозо-6-фосфата:
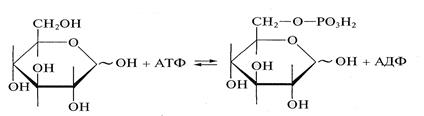
Реакция происходит на первой стадии гликолиза (процесса окисления глюкозы в пируват). Необходимо заметить, что все промежуточные продукты гликолиза представляют собой сложные эфиры моноз и фосфорной кислоты.
2. Окисление моноз в кислой и нейтральной среде приводит к образованию различных кислот. Окислению может подвергаться:
а) только карбонильная группа — «мягкое» окисление, например, бромной водой:
НО-СН2-(СНОН)n-СНО → НО-СН2-(СНОН)n— СООН
Гликоновые кислоты
б) карбонильная и первичная гидроксильная группы - «жесткое» окисление, например, раствором HNO3:
НО-СН2- (СНОН)n- СНО → НООС-СН2-(СНОН)n-СООН
Гликаровые кислоты
в) только первичная гидроксильная группа в мягких условиях при защите альдегидной группы:
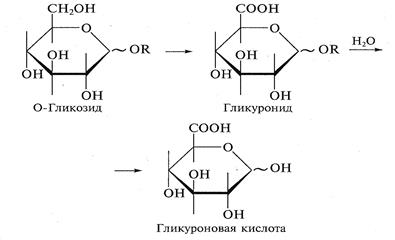
Гликурониды при нагревании легко декарбоксилируются, что приводит к образованию моноз с меньшим числом атомов углерода. Так можно получить из D-гликуронида пентозу — D-ксилозу.
Окисление моноз в щелочной среде сопровождается деструкцией углеродного скелета. Реакции окисления характерны не только для альдоз, но и для кетоз (в отличие от кетонов), что объясняется явлением эпимеризации моноз (см. далее). Окислению могут подвергаться и некоторые дисахариды, называемые восстанавливающими. Существуя преимущественно в форме полуацеталей, они обладают потенциально свободной альдегидной группой (в оксо-форме).
Восстанавливающие моно- и дисахариды восстанавливают ионы меди(II), входящие в состав комплекса с винной кислотой (С4Н606; H2tart) — реактив Фелинга [Cu(tart)2]2- или в состав комплекса с лимонной кислотой (C6H807; H3cit) — реактив Бенедикта [Cu(cit)]-, до оксида меди(I) Cu2O, а также ионы серебра в реактиве Толленса [Ag(NH3)2]OH до свободного серебра. Реакции используют как качественные на наличие восстанавливающих сахаридов.
3. Восстановление углеводов. Моносахариды подвергаются химическому либо билогическому восстановлению.
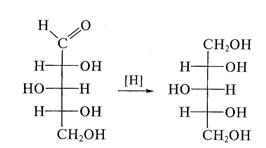
Восстановление моноз, как и всяких карбонильных соединений, приводит к превращению карбонильных групп в спиртовые; при этом образуются многоатомные спирты, называемые сахарными спиртами, или альдитами:
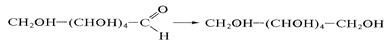
Помимо амальгамы натрия в водной (или вводно - спиртовой, или спиртовой) среде для восстановления моноз используют водород в присутствии катализаторов (Pt, Pd, Ni) и гидриды металлов (особенно NaBH4). Следует иметь в виду, что при восстановлении альдоз образуется один спирт, а при восстановлении кетоз получают два стеоизомерных полиола:
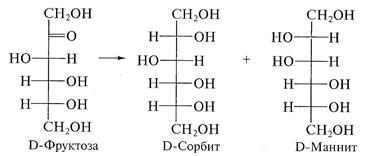
При восстановлении D-ксилозы образуется D-ксилит:
4. Реакция изомеризации (эпимеризации) всегда происходит по α-СН*-кислотному центру моносахаридов, которым является атом углерода, непосредственно связанный с карбонильной группой. Реакция протекает под действием разбавленных растворов щелочей или ферментативно (в условиях организма) и сопровождается внутримолекулярным окислением — восстановлением (диспропорционированием) атомов углерода С, и С2. В ходе этой перегруппировки вследствие переноса протона, осуществляемого под влиянием гидроксильного иона, возникает промежуточное соединение - ендиол. Превращения ендиола могут привести к образованию как кетозы, так и двух альдоз.
Таким образом, в результате реакции постепенно образуется равновесная смесь изомеров. Например, в результате эпимеризации D-глюкозы образуется D-манноза — эпимер глюкозы по С2 и D-фруктоза — структурный изомер глюкозы:
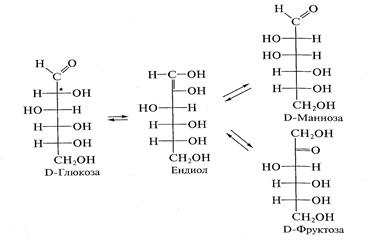
Пример реакции изомеризации в организме — ферментативное превращение глюкозо-6-фосфата в фруктозо-6-фосфат в процессе гликолиза.
Дата добавления: 2019-09-30; просмотров: 1382;











