Электронные эффекты заместителей
| Заместитель | Электронные эффекты | Характер совместно го действия | |
| индуктивный | мезомерный | ||
| Алкильные группы (R) | +I | − | }Электронодонорный |
| −О− | +I | +M | |
| −NH2, −NHR, −NR2 | −I | +M | |
| −ОH | −I | +M | |
| Алкоксигруппы (−ОR) | −I | +M | |
| −NH3+, −NR3+ | −I | − | }Электроноакцепторный |
| Галогены (F, Cl, Br, I) | −I | −M | |
| −NО2 | −I | −M | |
| −SО3H | −I | −M | |
| −COOH, −COOR | −I | −M | |
| >C=O | −I | −M |
С помощью табл. 6 можно прогнозировать характер изменения электронной плотности на реакционном центре молекулы, вызванного заместителем.
Особое значение явление делокализации электронной плотности имеет для сопряженных систем. Сопряжение - это образование единого электронного облака в результате взаимодействия негибридизованных  -орбиталей в молекулах с чередующимися двойными и одинарными связями.
-орбиталей в молекулах с чередующимися двойными и одинарными связями.
Различают два типа сопряженных систем (и сопряжений).
1.  ,
,  -Сопряжение — электроны делокализованы между двумя (и более) кратными связями. Например, в делокализации электронов в молекуле бутадиена участвуют четыре атома углерода:
-Сопряжение — электроны делокализованы между двумя (и более) кратными связями. Например, в делокализации электронов в молекуле бутадиена участвуют четыре атома углерода:
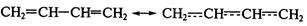
Делокализация электронов в молекуле бензола происходит с участием шести атомов углерода:

Кроме того, при осуществлении «кругового» сопряжения, как в бензоле, система получает дополнительный существенный выигрыш энергии, называемый энергией сопряжения. Например, энергия сопряжения молекулы бензола равна 15 кДж/моль.
2. p,  -Сопряжение — в делокализации принимают участие электроны
-Сопряжение — в делокализации принимают участие электроны  -связи и р-орбитали гетероатома; например, в молекулах ацетамида и пиррола:
-связи и р-орбитали гетероатома; например, в молекулах ацетамида и пиррола:

В случае молекулы ацетамида в делокализации участвуют три атома (С, О, N); в случае молекулы пиррола — пять атомов (4 атома С и атом N с неподеленной электронной1 парой). Чем длиннее система сопряжения, тем более она устойчива.
Дата добавления: 2019-09-30; просмотров: 563;











