Физические свойства алкинов
| Название | Температура кипения, 0С | Температура плавления, 0С |
| Ацетилен | -81,8 | -83,6 |
| Пропил | -102,7 | -23,3 |
| Бутин-1 | -122,5 | 8,5 |
| Бутин-2 | -32,3 | |
| Пентин-1 | -98,0 | 39,7 |
| Пентин-2 | -101,0 | 56,1 |
| Гексил-1 | -132,0 | 71,4 |
Низшие алкины С2-С4 - газы, С5-С6 - жидкости, высшие - твёрдые вещества. Температура кипения алкинов несколько выше, чем у соответствующих алкенов. Это связано с повышенным межмолекулярным взаимодействием в ряду алканов, поскольку они обладают некоторым дипольным моментом. По этой же причине растворимость низших алкинов в воде несколько выше, чем алкенов и алканов, однако она всё же очень мала.
Плотность и показатель преломления алкинов значительно выше, чем у алкенов и, тем более, алканов.
Химические свойства.Химические свойства алкинов обусловлены природой тройной связи, особенностями углеродных атомов, находящихся в состоянии sp-гибридизации. Типичными реакциями алкинов, так же как и для алкенов, являются реакции присоединения. Но они для алкинов протекают медленнее, чем для алкенов.
1. Гидрирование
В присутствии катализаторов (Pt, Pd, Ni) происходит присоединение водорода:
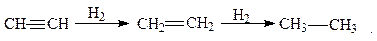
Тройная связь гидрируется легче, чем двойная. Реакцию можно остановить на стадии образования алкена.
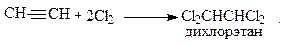
2. Галогенирование
Реакция взаимодействия с галогенами протекает медленнее, чем для алкенов. Эта реакция используется для синтеза растворителей:
3. Гидрогалогенирование
Гидрохлорированием ацетилена в промышленности получают винилхлорид:
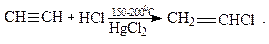
Из винилхлорида получают полимер – поливинилхлорид.
4. Гидратация
Непосредственная гидратация ацетилена приводит к образованию ацетальдегида (реакция открыта в 1881 г. Кучеровым М.Г.):
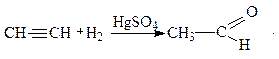
Ацетальдегид широко используется для получения ценных химических продуктов, как, например, уксусная кислота:
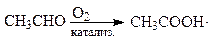
Уксусная кислота служит для получения химических волокон и пластмасс, растворителей и многих других продуктов. Она используется для кислотной обработки высокотемпературных скважин с целью увеличения нефтеотдачи пластов.
5. Присоединение синильной кислоты:
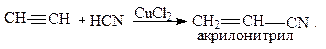
6. Присоединение органических кислот и спиртов:
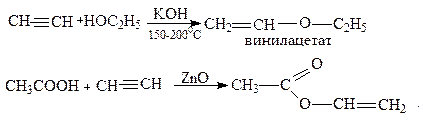
Образующиеся виниловые эфиры используются как мономеры для производства полимеров и пластических масс.
7. Окисление
Алкины окисляются легче алкенов. Процесс сопровождается разрывом углеродной цепи по месту тройной связи. При добавлении раствора перманганата кальция алкины быстро его обесцвечивают, что может быть использовано как качественная реакция на тройную связь:
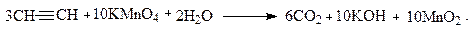
8. Реакции замещения
Отличительной особенностью алкинов является подвижность атомов водорода, соединённых с углеродными атомами, имеющими тройную связь. Этот атом легко замещается на галогены, металлы. В результате взаимодействия с металлами образуются ацетилениды.
Например, при действии на ацетилен аммиачным раствором CuOH образуется красно-коричневый осадок ацетиленида меди:
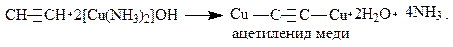
Эту реакцию можно использовать для обнаружения алкинов с концевой тройной связью и для выделения ацетиленовых углеводородных смесей. После осаждения и отделения ацетиленидов свободные алкины можно выделить действием минеральных кислот:
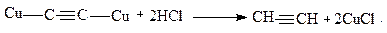
Промышленное значение имеют реакции полимеризации алкинов.
Дата добавления: 2016-12-09; просмотров: 3857;











