Физические свойства карбоновых кислот
| Название кислоты | Формула | Температура плавления, 0С | Температура кипения, 0С | Плотность d204 | |
| по системе ИЮПАК | тривиальные | ||||
| Метановая | Муравьиная | Н-СООН | 8,4 | 100,7 | 1,220 |
| Этановая | Уксусная | СН3СООН | 16,7 | 118,1 | 1,049 |
| Пропановая | Пропионовая | СН3-СН2-СООН | -22,0 | 141,1 | 0,992 |
| Бутановая | Масляная | СН3(СН2)2СООН | -6,5 | 163,8 | 0,964 |
| Пентановая | Валериановая | СН3(СН2)3СООН | -34,5 | 0,939 | |
| Гексановая | Капроновая | СН3(СН2)4СООН | -9,5 | - | |
| Гептановая | Энантовая | СН3(СН2)5СООН | -10,0 | 223,5 | 0,910 |
| Тетрадекановая | Миристиновая | СН3(СН2)12СООН | - | - | |
| Гексадекановая | Пальмитиновая | СН3(СН2)14СООН | - | - | |
| Октадекановая | Стеариновая | СН3(СН2)16СООН | 69,4 | - | - |
| Пропен-2овая | Акриловая | СН2=СН-СООН | 12,3 | - | |
 2-метилпропен-2-овая 2-метилпропен-2-овая
| Метакриловая | СН2=С-СООН СН3 | - | ||
| Бензолкарбоновая | Бензойная | 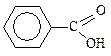
| 121,7 | - | |
| о-Бензол-1,2-дикарбоновая | Фталевая | 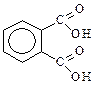
| - | - | |
| Этандиовая | Щавелевая | НООС-СООН | 189,5 | - | - |
| Пропандиовая | Малоновая | НООС-СН2СООН | 135,6 | - | - |
| Гексадиовая | Адипиновая | НООС(СН2)5СООН | - | - | |
| Бутен-2-диовая | Малеиновая | НООС-СН=СН-СООН | - | - | |
| Циклогексанкарбоновая | 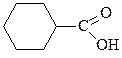
| - | 121(44) | 1,034422 | |
| 2,4-диметилциклогексанкарбоновая | 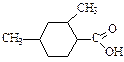
| 139(15) | 0,9785 | ||
| Циклопентанкарбоновая | 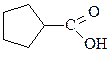
| 104(11) | 1,051017 | ||
| 3-метилциклопентанкарбоновая | 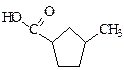
| 116(15) | 1,00622 |
Первые три члена ряда жирных кислот - бесцветные подвижные жидкости с резким раздражающим запахом, смешиваются с водой во всех соотношениях. Начиная с масляной кислоты - маслянистые жидкости, плохо растворимые в воде, с приятным запахом.
Высшие кислоты, начиная с декановой, - твёрдые соединения, лишённые запаха. Они практически не растворимы в воде, но растворяются в эфире и бензоле.
С повышением молекулярной массы кислот повышается их температура кипения и понижается плотность. Температуры плавления кислот проявляют те же закономерности, что и в ряду алканов. Температура кипения кислот изостроения ниже, чем у неразветвлённых кислот. Вследствие высокой полярности связи О-Н карбоновые кислоты образуют прочные межмолекулярные водородные связи. Поэтому низшие карбоновые кислоты менее летучи, чем этого можно было бы ожидать на основании их молекулярных масс. Во всех агрегатных состояниях (даже отчасти и в газообразном) преобладают димерные молекулы с двумя водородными связями:
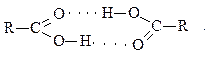
Все двухосновные кислоты - бесцветные кристаллические вещества. Низшие гомологи хорошо растворяются в воде.
Нафтеновые кислоты обладают всеми свойствами карбоновых кислот.
Нафтеновые кислоты, выделенные из нефти, представляют собой тёмную маслянистую жидкость с неприятным запахом. Они слабо растворимы в воздухе, хорошо растворимы во всех органических растворителях. Нафтеновые кислоты имеют низкую температуру застывания (до -800). Они обладают свойством сильно понижать поверхностное натяжение воды.
Нефтяные кислоты взаимодействуют с оксидами металлов, а при нагреве и с самими металлами, образуя соли. Это приводит к коррозии металлической аппаратуры. Нафтеновые кислоты легко образуют соли со свинцом, цинком, медью, менее с железом и ещё менее с алюминием.
По этой причине все нефтяные кислоты удаляют из нефтепродуктов в процессе их очистки. Для очистки нефти и нефтяных фракций от нефтяных кислот используют способность их при взаимодействии со щелочами, карбонатами или оксидами щелочных металлов образовывать нерастворимые в углеводородах, но растворимые в воде соли.
Применение.Технические нафтеновые кислоты (асидол, мылонафт), выделяемые из керосиновых и лёгких масляных дистиллятов, применяют в качестве растворителей смол, каучука. Используют для пропитки шпал и в ряде иных производств.
Соли щелочных металлов нафтеновых кислот обладают высокой поверхностной активностью, поэтому их применяют в качестве деэмульгатора при обезвоживании нефти и для приготовления моющих веществ и пластичных смазок.
40%-ный водный раствор натриевых солей нафтеновых кислот, получаемый из щелочных отходов при очистке керосиновых и дизельных топлив, используется как вещество, значительно стимулирующее рост сельскохозяйственных структур.
Соли нафтеновых кислот (нафтенаты) используют также в качестве компонентов смазок, работающих под высоким давлением (нафтенат свинца), антикоррозионных покрытий (нафтенаты свинца, алюминия, марганца, кобальта), присадок к топливам (нафтенаты железа, марганца). Нафтенаты меди предохраняют древесину и ткани от бактериального разложения.
Натриевые соли нафтеновых кислот используют в нефтяной промышленности для изоляции притока пластовых вод. При взаимодействии их с кальциевыми солями, содержащимися в пластовых водах, образуются нерастворимые в воде кальциевые соли нафтеновых кислот. Это приводит к закупорке пор породы и образованию водонепроницаемых экранов, способных предупредить движение воды к забою скважин.
Мылонафт применяют в качестве пеногасителя при приготовлении буровых растворов.
Фенолы.Фенолами называются органические соединения, содержащие гидроксильную группу, непосредственно связанную с ароматическим кольцом.
Физические свойства и применение. Простые фенолы представляют собой жидкости или твёрдые вещества с низкой температурой плавления (фенол - 43 0С, крезолы - 11 0С). Сам фенол заметно растворим в воде (9,3 г на 100 г воды) из-за образования водородных связей с ней, большинство других фенолов в воде растворяются плохо.
Номенклатура. Фенолы называют или тривиальными названиями, как производные простейших членов этого ряда - фенола (С6Н5ОН), крезола (СН3-С6Н5-ОН), или по систематической номенклатуре - добавляя окончание -ол к названию ароматического углеводорода.
Фенолы нефти. Содержание фенолов в некоторых нефтях может достигать 0,1-0,2%. Значительные концентрации их встречаются в конденсатах из залежей с высоким давлением, а также в пластовых водах.
В разных нефтях обнаружены следующие фенолы:
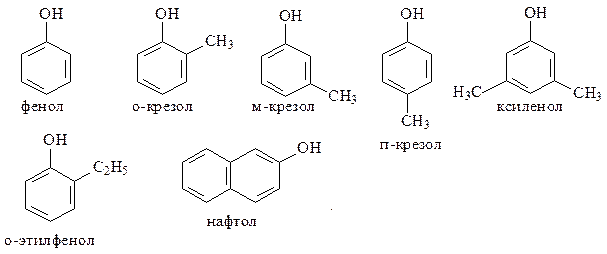
При обработке нефтей щёлочью содержащиеся в них фенолы образуют с ними соли - феноляты, которые выделяются вместе с нафтеновыми кислотами при подкислении щёлочью раствора. Для выделения фенолов смесь кислот и фенолов обрабатывают 5-6%-ным раствором бикарбоната натрия. При этом нафтеновые кислоты переходят в соли и растворяются в водном слое. Из реакционной смеси фенолы извлекают (экстрагируют) эфиром.
Технические фенолы, выделенные из нефти и нефтяных фракций, применяются как гербициды, фунгициды, дезинфицирующие препараты.
Кетоны и эфиры.Кетонами называются соединения, в которых карбоксильная группа >С=О соединена с двумя одинаковыми или разными алкильными или арильными группами.
Общая формула кетонов: R-CO-R1.
Номенклатура. Названия кетонов строят из названий исходного углеводорода и окончания -он.
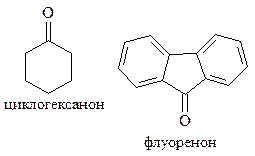
Номер атома углерода карбонильной группы у алифатических кетонов должен быть наименьшим:
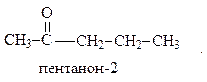
Используется также и такой способ наименования, при котором в порядке возрастания сложности называют обе углеводородные группы, связанные с карбонильной группой, и добавляют слово -кетон:
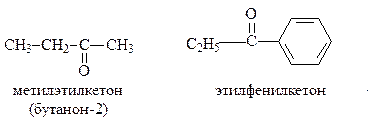
Некоторые кетоны имеют тривиальные названия:
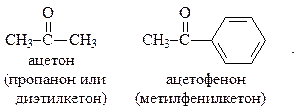
Физические свойства. Ацетон и следующие представители гомологического ряда кетонов - подвижные жидкости, высшие кетоны - твёрдые вещества. Температуры их кипения выше таковых для углеводородов со сходной молекулярной массой, поскольку между их молекулами существует диполь-дипольное взаимодействие.
Кетоны с небольшой молекулярной массой растворимы в воде. С увеличением молекулярной массы растворимость этих соединений уменьшается. Все кетоны хорошо растворимы в органических растворителях.
Кетоны нефти. Кетоны присутствуют в нефтях в ничтожных количествах. В газовых конденсатах найдены различные метилкетоны - от ацетона до метилбутилкетона. В нефтях обнаружены циклоалкилкетоны и алкилзамещённые флуореноны.
Эфиры.В нефтях обнаружены в ничтожных концентрациях простые: R-O-R1 и сложные эфиры:
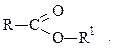
Вопрос об их строении и содержании в нефтях недостаточно изучен. Основная масса эфиров сосредоточена во фракциях, перегоняющихся выше 370 0С.
Значительное количество кислорода приходится на смолистые вещества, которые содержат кислород в составе циклов.
Сернистые соединения.В нефтях содержатся как неорганические, так и органические соединения серы: элементарная сера, сероводород, тиолы, сульфиды, ди- и полисульфиды, тиофены. Из них основную долю составляют сульфиды и тиофены.
Существуют и смешанные серу- и кислородсодержащие соединения - сульфоны, сульфоксиды.
В настоящее время в нефтях обнаружено более 250 серосодержащих соединений.
Элементарная сера содержится в нефтях в растворённом состоянии. Количество её может колебаться от 0,0001 до 0,1 % (масс.) и, как правило, пропорционально содержанию серы в нефти.
Элементарная сера содержится лишь в нефтях, связанных с известняковыми или сульфатно-доломитовыми отложениями. При хранении таких нефтей элементарная сера собирается в отстое на дне нефтехранилищ.
При нагревании нефти (в процессе перегонки) сера частично реагирует с углеводородами:
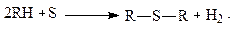
Сера попадает в дистилляты из исходной нефти, а также образовывается в них за счёт термического распада сераорганических соединений.
Сероводород в пластовых условиях может содержаться как в газах, так и в растворённом состоянии в нефтях. Количество растворённого в нефтях сероводорода может доходить до 0,02% масс. При нагревании нефти в процессе её переработки сероводород образуется за счёт разложения нестабильных сераорганических соединений. Образование сероводорода происходит и при взаимодействии элементарной серы с углеводородами.
Тиолы.Тиолы - сернистые аналоги спиртов и фенолов - гидроксильных производных углеводородов. Они содержат тиольную (меркаптановую) группу -SН. Общая формула тиолов: R-SH.
Номенклатура. Если R в общей формуле - алкильная или циклоалкильная группа, то тиолы называют тиоспиртами, если R - арильная группа - тиофенолами. По систематической номенклатуре названия тиоспиртов образуют от названия соответствующего углеводорода и окончания -тиол. Кроме того, часто используют (в том числе и в нефтяной промышленности) и более старые обозначения, согласно которым к названию алкильной или арильной группы добавляют слово -меркаптан.
Тиофенолы называют также арентиолами или меркаптоаренами. Часто перед названием соответствующего фенола добавляют префикс-тио:
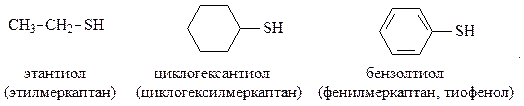
Физические свойства. Низшие меркаптаны - легко летучие жидкости с сильным неприятным запахом, который можно обнаружить при разбавлении в миллион раз. Поэтому их добавляют к природному газу в качестве одоранта (придаёт запах) для обнаружения его утечки в газопроводах. Меркаптаны плохо растворимы в воде и хорошо - в углеводородах и органических растворителях. Они кипят при более низкой температуре, чем соответствующие им спирты. Это объясняется меньшей ассоциацией их молекул, вследствие того, что атом серы менее электроотрицателен, чем кислород, и поэтому менее склонен к образованию водородных связей.
Химические свойства. Тиолы обладают слабыми кислотными свойствами, поэтому они легко взаимодействуют со щелочами, образуя соли - тиоляты (меркаптиды):
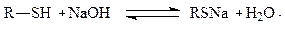
Эта реакция обратима и легко протекает лишь с низшими меркаптанами. При использовании этой реакции в промышленности для удаления меркаптанов из нефтяных фракций полного их выделения не наблюдается в связи с тем, что образующиеся высокомолекулярные меркаптиды легко гидролизуются водой. Чем выше молекулярная масса меркаптанов, тем легче гидролизуются меркаптиды и тем труднее становится выделять их с помощью щёлочи. Меркаптаны легко образуют соли с металлами (особенно тяжёлыми) и их оксидами, вызывая коррозию металла:
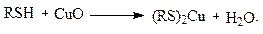
Образующиеся меркаптиды очень плохо растворяются в нефтепродуктах и выпадают в осадок, который забивает фильтрующие элементы двигателей, заправочных и перекачивающих устройств.
Относительно слабые окислители (кислород воздуха) окисляют меркаптаны до дисульфидов:

Эта реакция в присутствии катализаторов используется при облагораживании бензинов.
Сильные окислители (HNO3, H2O2 и др.) окисляют меркаптаны до сульфокислот:
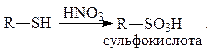
При нагревании происходит разрыв связи С-S, и меркаптаны превращаются в углеводороды:
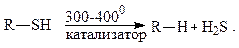
Тиолы (меркаптаны) нефти. Метилмеркаптан (т. к. 5,0 0С) и этилмеркаптан (т.к. 37 0С) могут содержаться в природном и попутном газах наряду с сероводородом. Меркаптаны встречаются, главным образом, в бензиновых и керосиновых фракциях.
Содержание меркаптанов в различных нефтях колеблется от 0 до 75 % от всех содержащихся в них сернистых соединений.
Из разных нефтей выделено более 50 меркаптанов с числом углеродных атомов от 1 до 8. Сюда относятся алкил-, циклоалкил- и арилмеркаптаны.
Сульфиды.Сульфиды являются сернистыми аналогами простых эфиров. Общая формула сульфидов R-S-R1.
Номенклатура. По правилам систематической номенклатуры название сульфидов составляют из названий алкильных групп и окончания -сульфид.
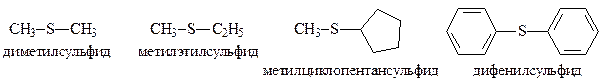
Циклические сульфиды называют, прибавляя приставку тиа- к названию циклического соединения-основы. Для них используются также тривиальные и полутривиальные названия.
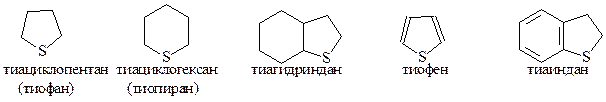
Физические свойства. Сульфиды - неприятно пахнущие жидкости с температурой кипения несколько более высокой, чем у тиолов с той же молекулярной массой; плохо растворимы в воде и хорошо в серной кислоте и органических растворителях.
Химические свойства сульфидов. Вследствие наличия двух свободных пар у атома серы сульфиды образуют нерастворимые в углеводородах комплексные соединения с различными электроноакцепторными соединениями: галогенидами металлов (AlBr3,SnCl4,TiCl2), фтористым водородом, фторидом бора (BF3), сернистым ангидридом и др. На этой способности основаны методы их выделения из нефтяных фракций.
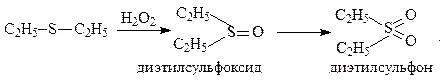
В зависимости от условий сульфиды могут окисляться сильными окислителями до сульфоксидов, а затем до сульфонов.
При нагревании сульфиды разлагаются с образованием сероводорода, меркаптанов и алкенов:
С увеличением молекулярной массы сульфидов термическая стабильность их падает.
Тиофены обладают самой высокой термической стабильностью из всех сернистых соединений. По своим химическим свойствам тиофены напоминают арены.
Сульфиды нефти. В нефтях найдено более 40 сульфидов, главным образом алкилсульфиды, в незначительных количествах обнаружены алкилциклоалкил-, алкилфенил- и дифенилсульфиды, алкилпроизводные тиопирана.
Алкил-, циклоалкил- и арилсульфиды составляют 50-70 %, алкилтофаны 40-50% (масс.) от суммы сернистых соединений лёгких и средних фракций нефтей.
В керосиновых и масляных фракциях содержатся полициклические сульфиды:
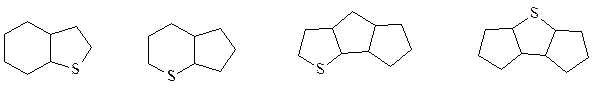
В некоторых нефтях содержатся циклические сульфиды, состоящие из тиациклопентана, конденсированного с бензольным кольцом: тиаиндан, диалкилтиаинданы.
Большую группу соединений, содержащихся в нефтях, средней и высококипящих фракциях нефтей и особенно в продуктах их термической переработки составляют тиофен и его производные. В нефтях содержатся алкилзамещённые тиофена. В высококипящих фракциях значительно более распространены арилпроизводные тиофана и тиофена и гибридные соединения.
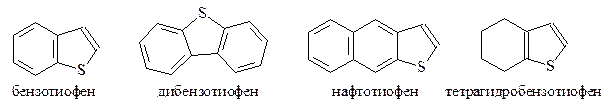
Дисульфиды. Дисульфиды - соединения общей формулы R-S-S-R1. Называют их аналогично сульфидам, но с тем исключением, что окончание -сульфид заменяется окончанием -дисульфид, а частица -тио - частицей -дитио. Например:
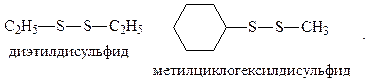
Дисульфиды - тяжёлые жидкости с неприятным запахом, почти нерастворимые в воде и легко растворимые в органических растворителях.
Дисульфиды находятся в нефтях в небольших количествах.
Предполагают, что в пластовых нефтях дисульфиды отсутствуют, они образуются из меркаптанов в результате окисления их кислородом воздуха после добычи нефти.
С повышением молекулярной массы и температуры кипения нефтяных фракций содержание дисульфидов возрастает, но до определённого предела, так как они являются термически неустойчивыми веществами.
По своим химическим свойствам дисульфиды подобны сульфидам. При нагревании они разлагаются с образованием меркаптанов, сульфидов и сероводорода. Дисульфиды легко восстанавливаются до меркаптанов, что используется при их определении в присутствии других сераорганических соединений:
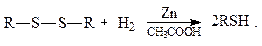
Сернистые соединения нефтей.В зависимости от природы нефти содержание серы в нефтях может изменяться от десятых долей до нескольких процентов.
Содержание различных классов сернистых соединений в некоторых нефтях представлено в табл. 17.
Распределение сернистых соединений по фракциям нефти различно. С повышением температуры кипения фракций содержание сернистых соединений увеличивается.
Таблица 17
Распределение сернистых соединений в высокосернистых нефтях
различных месторождений России
| Регион | Содержание серы, % масс. | Распределение серы в расчёте на общее её содержание, % масс | ||
| Тиолы | Сульфиды | Гомологи тиофена и высокомолекулярные структуры | ||
| Башкирская АССР | 1,9-4,0 | 0-10 | 6-40 | 50-94 |
| Татарская АССР | 0,9-4,0 | 0-2,6 | 11-36 | 61-89 |
| Куйбышевская обл. | 2,0-3,7 | 0,09-7,3 | 7,4-24 | 69-92 |
| Оренбургская обл. | 2,6-3,2 | 0,72-2,7 | 7,3-20 | 77-92 |
| Пермская обл. | 1,0-3,1 | 0-7,2 | 7,6-29 | 63-93 |
| Сибирь | 0,9-3,0 | 0-74 | 0-28 | 26-92 |
Большая часть (70-90% масс.) их сосредоточена в тяжёлых нефтяных остатках (мазуте и гудроне) и особенно в асфальто-смолистой части.
Распределение сернистых соединений по нефтяным фракциям зависит от типа нефти (табл. 18).
Таблица 18
Распределение серы по фракциям сернистых и
высокосернистых нефтей, % масс.
| Регион | Фракции, 0С | |||
| н.к.-120 | 120-200 | 200-250 | 250-300 | |
| Башкирская АССР | 0,02-0,57 | 0,08-1,74 | 0,35-2,5 | 0,67-3,95 |
| Татарская АССР | 0,02-0,25 | 0,05-1,04 | 0,17-2,29 | 0,72-3,13 |
| Куйбышевская обл. | 0,02-0,27 | 0,02-0,75 | 0,02-1,61 | 0,07-3,18 |
| Оренбургская обл. | 0,01-0,18 | 0,11-0,67 | 0,38-1,17 | 1,18-2,4 |
| Пермская обл. | 0,02-0,10 | 0,06-0,59 | 0,12-1,56 | 0,25-2,59 |
| Сибирь | 0,01-0,05 | 0,02-0,36 | 0,16-0,72 | 0,43-1,58 |
Содержание сернистых соединений в нефтяных фракциях можно приближённо определять по эмпирической формуле А.К. Каримова:
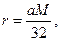
где r- содержание сернистых соединений в данной фракции, % масс.;
а - содержание серы в данной фракции, % масс.;
М - молекулярная масса фракции.
В табл. 19 для примера приведён групповой состав сернистых соединений двух нефтей с общим содержанием серы в одной около 1 % (Сызранская нефть), в другой около 5% (Чусовская нефть).
Таблица 19
Дата добавления: 2016-12-09; просмотров: 3778;











