Физические свойства изомерных алканов
| Название | Химическая формула | Температура кипения, 0С | Температура плавления, 0С | Плотность r204 |
| 2-метилпропан (изобутан) | СН3СН(СН3)СН3 | -11,7 | -159,6 | - |
| н-бутан | СН3СН2СН2СН3 | -0,5 | -133,3 | 0,579 |
| 2,2-диметилпропан (неопентан) | СН3С(СН3)2СН3 | 9,5 | -16,6 | 0,591 |
| 2-метилбутан (изопентан) | СН3СН2СН(СН3)СН3 | 27,8 | -159,9 | 0,62 |
| 2,2-диметилбутан (неогексан) | СН3С(СН3)2СН2СН3 | 49,7 | -99,7 | 0,649 |
| 2,3-диметилбутан (диизопропил) | СН3СН(СН3)СН(СН3)СН3 | 58,0 | -128,4 | 0,662 |
| 2-метилгексан (диметилпропилметан) | СН3СН(СН3)СН2СН2СН3 | 60,3 | 153,7 | 0,660 |
| 3-Метилпентан (диэтилметилметан) | СН3СН2СН(СН3)СН2СН3 | 63,3 | - | 0,664 |
Указанные закономерности становятся понятными, если вспомнить, что для перехода жидкого вещества в газообразное необходимо преодолеть межмолекулярные взаимодействия. Форма разветвлённых молекул стремится к сферической, при этом площадь поверхности уменьшается, и в результате уменьшаются межмолекулярные силы, которые теперь преодолеваются при более низкой температуре.
На температуру плавления алканов в кристаллическом состоянии большое влияние оказывает строение молекул, их способность «упаковываться» в кристаллы. Поэтому температура плавления приведённого ниже 2,2–диметилбутана – 99,7 0С, а 2,3–диметилбутана – 128,4 0с.
Все алканы легче воды, их плотность не превышает 0,8 г/см3.
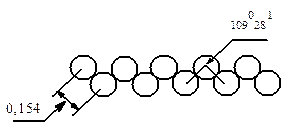
Алканы практически не растворимы в воде, но хорошо растворимы в органических растворителях. Метан, этан и высшие гомологи не имеют запаха, средние обладают запахом бензина. В молекулах алканов цепочки углеродных атомов имеют зигзагообразную форму. Угол между валентностями составляет 1090281; центры углеродных атомов расположены друг от друга на расстоянии 0,154 нм, расстояние от центра углеродного атома до центра атома водорода 0,11 нм.
В процессе разработки месторождений физическое состояние и свойства углеводородов с изменением температуры и давления не остаются постоянными. Для правильного установления технологического режима эксплуатации месторождений и систем сбора нефти и газа необходимо знать изменение состояний и свойств углеводородов в широком диапазоне давления и температуры.
Химические свойства и переработка.В молекулах алканов, как известно, все атомы связаны между собой прочными σ-связями, а валентности углеродных атомов полностью насыщены водородом. Поэтому алканы не вступают в реакции присоединения. Они проявляют при обычных условиях чрезвычайно высокую химическую инертность: не взаимодействуют с ионными реагентами (кислотами, щелочами), окислителями, активными металлами (поэтому, например, металлический натрий можно хранить в керосине).
По этой причине предельные углеводороды в своё время получили название парафинов* (от лат. рarum affinis - малое сродство). (* - В нефтяной практике парфинами называют твёрдые углеводороды, содержащиеся в нефтях и нефтепродуктах.)
Основные химические превращения алканов идут только при сообщении им достаточно высокой энергии (за счёт нагревания или УФ-облучения). При этом может произойти или разрыв связи С-Н с последующей заменой атома водорода на другой атом или группу атомов (реакции замещения), или же разрыв молекулы по связи С-С (реакции расщепления).
Несмотря на то, что энергии этих связей равны соответственно: 376,8-410,3 и 314-368,4 кДж/моль, разрыв предпочтительнее идёт по связи С-Н. Это связано с большей доступностью связи С-Н для атаки химических реагентов.
Наибольший интерес для нефтехимии представляют следующие реакции:
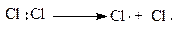
Галогенирование. Эта реакция идёт сравнительно легко с замещением атомов водорода в алканах на галогены. Из галогенов наиболее широко используется хлор, вследствие его доступности, дешевизны и высокой химической активности.
Как было установлено Н.Н. Семёновым, эта реакция протекает по радикально цепному механизму.
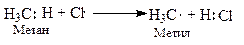
Молекулярный хлор под влиянием света расщепляется на атомный, который инициирует (начинает) радикальную реакцию; он отщепляет водород от метана, образуя радикал - метил и хлористый водород. Метильный радикал взаимодействует с молекулярным хлором и стабилизируется в первый продукт хлорирования метана - хлористый метил, который по аналогичной схеме подвергается дальнейшему хлорированию, образуя последовательно хлористый метилен, хлороформ и тетрахлорметан (четырёххлористый углерод):

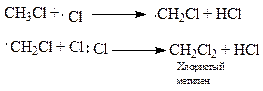
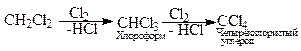
Подобно метану могут подвергаться хлорированию и другие алканы. Хлорирование углеводородов проводится в промышленных масштабах в паровой и жидкой фазах различными способами: при нагревании до 400-500 0С (термическое хлорирование), в присутствии катализаторов (каталитическое хлорирование) при специальном освещении реагирующих компонентов (фотохимическое хлорирование).
Хлорпроизводные метана и других низших алканов являются хорошими растворителями жиров, синтетических смол и каучуков, нитро- и ацетилцеллюлозы. Их можно использовать и для очистки призабойной зоны нефтяных скважин от асфальто-смолистых и парафиновых отложений. Применяют также и при депарафинизации масел.
Хлорпроизводные алканов используют для получения спиртов, в том числе и высших спиртов:

При пропускании хлористого метила (или смеси его с хлорзамещёнными ароматическими углеводородами) над медно-кремниевым сплавом при 300 0С образуются алкил- и арилхлорсиланы:
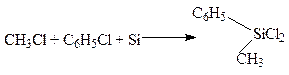
Алкил- и арилхлорсиланы являются исходным продуктом в синтезе кремнийорганических соединений, применяемых в производстве силиконовых жидкостей, консистентных смазок, смол и каучуков.
Хлороформ и четырёххлористый углерод используют для получения хлорфтор- и фторпроизводных:
CCl4 + HF → CCl2F2 ,
которые применяют в качестве хладоагентов - фреонов.
Полностью фторированные алканы применяют в качестве инертных теплоносителей, в производстве полимеров-фторопластов.
Хлорирование твёрдых парафинов осуществляют для получения присадок, понижающих температуру застывания масел (депрессорные присадки).
Нитрование. Нитрование алканов осуществляют с помощью азотной кислоты при температуре 200-450 0С. Нитрование всегда сопровождается частичным разложением углеводородов, что приводит к получению нитросоединений с меньшим числом атомов углерода. Из пропана таким путём помимо 1- и 2-нитропропанов образуются нитроэтан и нитрометан:

Нитрометан, нитроэтан, нитропропан являются хорошими растворителями эфиров целлюлозы, полимеров, лаков. Они могут применяться в качестве добавок, снижающих температуру самовоспламенения дизельных топлив.
Восстановлением нитроалканов в кислой среде можно получить амины:
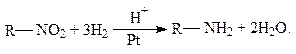
Амины используют для получения ингибиторов коррозии, поверхностно-активных веществ, для очистки газов от сероводорода.
Сульфирование. При слабом нагревании дымящая серная кислота сульфирует алканы, т. е. атом водорода в них замещается на сульфогруппу:
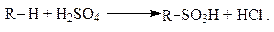
В результате образуются алкансульфокислоты.
Сульфохлорирование. При действии на алканы смеси сернистого газа и хлора идёт реакция сульфохлорирования:
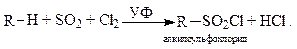
Сульфохлориды легко гидролизуются до сульфокислот:
R – SO2Cl + H2O → R – SO3H .
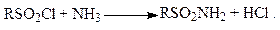
Взаимодействием сульфохлоридов с избытком аммиака получают сульфамиды:
Сульфокислоты могут быть получены также и реакцией сульфоокисления:
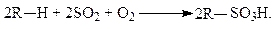
Алкансульфокислоты образуют со щелочами соли – сульфонаты:

Сульфонаты и сульфамиды с 12-18 и выше атомами углерода, получаемые на основе жидких парафинов, выделяемых из дизельных фракций, служат в качестве поверхностно-активных и моющих веществ, эмульгаторов нефти и флотационных реагентов.
Дегидрирование. В присутствии катализатора при нагревании из алканов за счёт разрыва связи С-Н происходит отщепление атомов водорода, что приводит к образованию алкенов. Например, дегидрированием этана можно получить этилен:
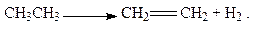
В результате дегидрирования бутана образуется бутилен или бутадиен:
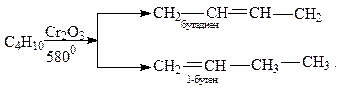
Образующаяся смесь изомерных бутиленов широко применяется для получения полимербензинов и в синтезе алкилатов, являющихся высокооктановыми компонентами бензинов.
Особенно важен процесс дегидрирования бутана с целью получения бутадиена, который необходим для синтеза каучуков:
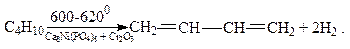
Дегидрированием изопентана, выделяемого из газового бензина и газов нефтепереработки, получают изопрен, также важный полупродукт для синтеза каучуков:
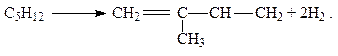
Дегидрирование низших алканов при очень высоких температурах приводит к образованию ацетилена:
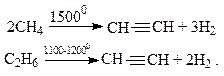
Изомеризация. Под влиянием катализаторов при нагревании алканы изомеризуются в углеводороды разветвлённого строения:
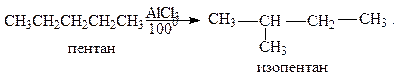
Реакция изомеризации используется для повышения октанового числа бензинов.
Окисление.В присутствии большого избытка кислорода (или воздуха) при высокой температуре алканы сгорают полностью до воды и диоксида углерода, например:
CnH2n+2 + (3n+1)O2 → nCO2 + (n+1)H2O .
Эта реакция используется, главным образом, при получении из природного газа и нефтепродуктов тепловой энергии.
Неполное окисление метана кислородом воздуха приводит к образованию смеси оксида углерода и водорода, называемой синтез-газом:
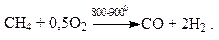
Синтез-газ получают также конверсией метана водяным паром или диоксидом углерода:
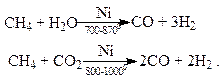
Синтез-газ используют для получения многих органических продуктов.
Окисление алканов кислородом воздуха в более мягких условиях приводит к получению смеси карбоновых кислот, спиртов, альдегидов, кетонов.
Окислением метана и продуктов его окисления можно получить метиловый спирт, формальдегид, муравьиную кислоту:

Метиловый спирт применяют в качестве горючего, растворителя, для предотвращения образования газовых гидратов в трубопроводах.
Формальдегид применяется во многих органических промышленных синтезах, большое количество его используется для получения пластмасс, пластификаторов, взрывчатых веществ. Применяют также для предотвращения бактериальной коррозии металлов, для борьбы с сульфатвосстанавливающими бактериями.
При неполном окислении этана образуются метиловый СН3ОН и этиловый С2Н5ОН спирты, уксусный альдегид СН3СНО. Для преимущественного получения спиртов используют воздух, обеднённый кислородом.
Исключительный интерес для промышленности представляет процесс неполного окисления бутана, позволяющий получить большое количество альдегида и уксусной кислоты:
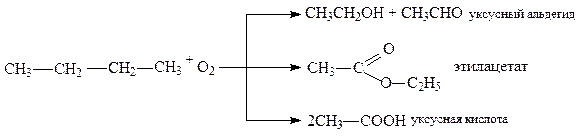
В зависимости от температуры процесса соотношение между продуктами окисления может существенно меняться.
Продукты окисления низших алканов находят применение в качестве готовой продукции или полупродуктов при синтезе присадок, моющих средств, алкилирующих агентов, компонентов ракетного топлива, растворителей.
Важное промышленное значение приобрело каталитическое окисление высших алканов (С12-С25) с целью получения высших жирных спиртов и жирных кислот (ВЖС) (работы акад. С.С. Наметкина).
Сырьём являются парафины, получаемые при депарафинизации нефтепродуктов:
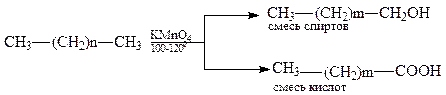
Образующиеся продукты используются для получения поверхностно-активных соединений, моющих средств, пластификаторов.
Комплексообразование. Газообразные алканы образуют твёрдые комплексы с водой. Эти комплексы относятся к так называемым соединениям включения или клатратным соединениям. Комплексы газообразных углеводородов с водой образуются при пониженной температуре (~ 0°С). Иногда в газопроводах они могут быть причиной закупорки. В присутствии молекул газа вода кристаллизуется с образованием клеток, в которых заключены молекулы алкана («гость»). Так, пропан при давлении 0,4 Мпа и температуре 2°С образует в воде кристаллическое соединение С3Н8·17Н2О.
Алканы нормального строения, начиная с гептана, образуют при комнатной температуре соединения включения с мочевиной H2N–CO–NH2. В этих соединениях молекулы мочевины соединяются между собой с помощью водородных связей и образуют спиралевидные гексагональные каналы диаметром 4,9 А0, в которых находятся молекулы алкана.
Диаметр эффективного поперечного сечения молекулы алкана нормального строения 3,8 – 4,2 А0. Поэтому молекулы н-алканов умещаются в этом канале в отличие от молекул изоалканов, эффективный диаметр которых значительно больше. Благодаря этому комплексообразованием с мочевиной можно отделить н-алканы от разветвлённых алканов. Однако слаборазветвлённые алканы, молекулы которых имеют участок прямой цепи из 10 атомов углерода, также образуют устойчивые комплексы с мочевиной.
Тиомочевина
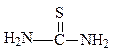
образует соединения включения с изопарафинами. Диаметр гексагонального канала, образованного молекулами тиомочевины в соединении включения, равен 7А0; в этот канал могут быть легко включены молекулы даже сильно разветвлённых алканов. Молекулы углеводородов в соединениях включения мочевины и тиомочевины удерживаются с помощью сил Ван – дер – Ваальса. Возможно также наличие слабых водородных связей.
Алканы нефти.Алканы занимают исключительно важное место среди углеводородов нефти. Так, природные газы представлены почти исключительно алканами.
Общее содержание алканов в нефтях составляет 40-50% (об.), а в некоторых нефтях оно достигает 50-70%. Однако есть нефти, в которых содержание алканов составляет всего 10-15%.
Лёгкие фракции любых нефтей почти целиком состоят из алканов. С повышением средней молекулярной массы фракций нефти содержание в них алканов уменьшается. В средних фракциях, выкипающих в пределах 200-300 0С, их содержится обычно не более 55-61%, а к 500 0С количество этих углеводородов снижается до 19-5% и менее.
Газообразные алканы. В зависимости от месторождений и методов добычи углеводородные газы подразделяются на природные, попутные и газы газоконденсатных месторождений.
Природные газы - газы чисто газовых месторождений. Они состоят, в основном, из метана (93-99%) с небольшой примесью этана, пропана, бутанов, пентанов. Во многих природных газах содержится значительное количество диоксида углерода, азота, а также сероводорода и благородных газов (Ar, Ne и др.).
В виду резкого преобладания метана большинство природных газов относят к так называемым сухим газам.
Месторождения природного газа размещаются в различных районах нашей страны. Особенно богата природным газом Западная Сибирь.
Попутные газы. Так принято называть газообразные углеводороды, сопровождающие сырую нефть. В условиях пластового давления эти газы растворены в нефти и в процессе её добычи выделяются вследствие снижения давления. Для этих газов характерно высокое содержание метана и наличие значительных количеств этана, пропана, бутанов и высших углеводородов вплоть до октана. Такие газы в отличие от сухих принято называть жирными или богатыми. Состав газов колеблется в значительных пределах и зависит от типа месторождения и условий добычи нефти. Попутные газы служат источником извлечения из них лёгкого бензина.
Газы газоконденсатных месторождений. Некоторые газовые месторождения с высоким пластовым давлением (до 25-30 МПа) отличаются тем, что газы насыщены жидкими нефтяными углеводородами. При разработке этих месторождений давление снижается, жидкие углеводороды конденсируются и могут быть отделены от газа в виде жидкого конденсата. После отделения конденсата газ приближается по составу к сухим газам, а конденсат содержит бензиновые и керосиновые фракции.
Химический состав газов, полученных из различных месторождений, приведён в табл. 11.
Таблица 11
Состав газов некоторых месторождений (% об.)
| Месторождения | СН4 | С2Н6 | С3Н8 | С4Н10 | С5Н12 | СО2 | Н2S | N2 +другие |
| Газовые | ||||||||
| Заполярное | 98,6 | 0,07 | 0,02 | 0,013 | 0,011 | 0,18 | - | 1,11 |
| Уренгойское | 95,2 | 1,0 | 0,33 | 0,07 | 0,03 | 0,40 | - | 3,009 |
| Северо-Ставропольское | 98,3 | 0,03 | 0,1 | 0,04 | 0,02 | 0,13 | - | 0,11 |
| Газоконденсатные: | ||||||||
| Вуктыльское | 74,8 | 8,7 | 3,90 | 1,80 | 6,40 | 0,10 | - | 4,30 |
| Газлинское | 93,0 | 3,2 | 0,90 | 0,47 | 0,13 | 0,10 | - | 2,20 |
| Оренбургское | 84,8 | 4,5 | 1,40 | 0,30 | 1,50 | 1,15 | 35,0 | 5,00 |
| Астраханское | 47,48 | 1,92 | 0,93 | 0,56 | 3,08 | 21,55 | 21,5 | 1,98 |
| Попутные газы: | ||||||||
| Ромашкинское | 39,0 | 20,0 | 18,5 | 6,2 | 4,7 | 0,1 | - | 11,5 |
| Туймазинское | 41,0 | 21,0 | 17,4 | 6,8 | 4,6 | 0,1 | 2,0 | 7,1 |
| Жизновское | 82,0 | 6,0 | 3,0 | 3,5 | 1,0 | 5,0 | - | 1,5 |
| Небит-Дагское | 85,7 | 4,0 | 3,5 | 2,0 | 1,4 | 2,09 | 0,01 | 1,3 |
| Сызранское | 31,9 | 23,9 | 5,9 | 2,7 | 0,8 | 1,6 | 1,70 | 31,5 |
| Лирхановское | 30,1 | 20,2 | 23,6 | 10,6 | 4,8 | 1,5 | 2,40 | 6,8 |
Природные газы широко используются как бытовое и промышленное топливо, служат ценнейшим сырьём для химической и нефтехимической промышленности. Сжиженные нефтяные газы используют в качестве растворителей для извлечения остаточной нефти из пласта.
Жидкие алканы. Содержание жидких алканов в зависимости от месторождения нефти колеблется от 10 до 70%. Наиболее богаты ими мангышлакские, сибирские, татарские, башкирские нефти. При фракционной разгонке эти углеводороды попадают в бензиновый (С5-С10) и керосиновый (С11-С16) дистилляты. В настоящее время в нефтях найдены все возможные изомеры пентана, гексана и гептана.
Обычно нефть содержит, главным образом, два-четыре десятка индивидуальных нормальных и изомерных алканов, остальные присутствуют в незначительных количествах.
Наиболее характерно содержание алканов нормального и слаборазветвлённого строения. Причём из последних наиболее часто встречаются метилзамещённые.
В табл. 12 приведены усреднённые данные о содержании индивидуальных алканов в бензиновых фракциях нефтей.
Из 18 изомеров октана обнаружено 17. Из 35 возможных изомеров нонана обнаружено 24.
Декан и его десять изомеров выделены, а большая часть обнаружены спектроскопическим методом.
Из углеводородов С11-С16 найдены ундекан, додекан, три- и тетрадекан, пентадекан и гексадекан.
Таблица 12
Относительное содержание алкановых углеводородов во фракциях различных нефтей
| Углеводороды | Среднее содержание во фракции, % от суммы алканов | ||
| для нефтей СНГ | для зарубежных нефтей | ||
| Фракция 60-95 0С | |||
| н-гексан | 23,0 | 35,9 | |
| 2-метилпентан | 14,9 | 14,0 | |
| 3-метилпентан | 12,0 | 12,0 | |
| 2,2-диметилпентан | 3,3 | 1,5 | |
| 2,4-диметилпентан | 4,0 | 3,5 | |
| 2,3-диметилпентан | 8,8 | 2,6 | |
| 3,3-диметилпентан | 1,7 | - | |
| 2-метилгексан | 14,0 | 20,0 | |
| 3-метилгексан | 14,9 | 10,5 | |
| 3-этилпентан | 3,4 | - | |
| Фракция 95-122 0С | |||
| н-гептан | 52,6 | 49,2 | |
| 2,2-диметилгексан | 1,1 | 5,7 | |
| 2,3-диметилгексан | 4,0 | 11,8 | |
| 2,4-диметилгексан | 4,7 | 5,1 | |
| 2-метилгептан | 23,8 | - | |
| 3-метилгептан | 8,1 | - | |
| 4-метилгептан | 5,7 | 28,2 | |
В некоторых нефтях обнаружены изопреноидные углеводороды -разветвлённые алканы с правильным чередованием метильных заместителей в цепи через три метиленовые группы:
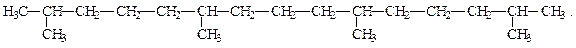
Содержание их в различных нефтях составляет до 9 %.
Изопреноидные углеводороды представляют особенный интерес для геохимии нефти, поскольку обладают специфической структурой, характерной для биохимических компонентов. Особенности их строения и высокая концентрация в различных нефтях свидетельствуют в пользу их биогенной природы.
При изучении распределения в нефтях нормальных алканов и алканов изостроения обнаружены закономерности, связанные с типом нефти. В нефтях метанового типа преобладают нормальные алканы (до 50 %). В нефтях нафтенового типа содержатся преимущественно изоалканы (до 75 % и более). Они могли образоваться в нефтях из фитола - ненасыщенного алифатического спирта растительного происхождения, который является составной частью хлорофилла.
Так как нефти метанового типа относятся к старым нефтям, преобладание в них алканов нормального строения объясняют протеканием реакций отщепления боковых цепей у углеводородов изостроения. Преимущественное содержание изоалканов в нафтеновых нефтях свидетельствует, что они относятся к молодым, не претерпевшим ещё значительных превращений.
Жидкие алканы имеют большое значение в жидких топливах. Установлено, что нормальные алканы являются носителями детонирующих свойств, в результате чего их присутствие в бензинах нежелательно.
Напротив, они желательны в дизельном топливе, т. к. с увеличением длины цепи повышается так называемое цетановое число, которое характеризует способность дизельного топлива к воспламенению.
Алканы разветвлённого строения придают бензинам антидетонационные свойства, характеризуемые октановым числом.
Жидкие алканы, входя в состав бензина, керосина и других продуктов переработки нефти, используют в первую очередь как топлива. Значительное количество нормальных алканов используют для получения синтетических жирных кислот, спиртов и поверхностно-активных веществ. Кроме того, они являются сырьём для микробиологической промышленности, производящей белково-витаминные концентраты.
Твёрдые алканы. Твёрдые алканы присутствуют во всех нефтях. Для всех твёрдых алканов укрепилось техническое название “парафины”. Парафинов в нефтях содержится мало (0,1-5%). Однако встречаются высокопарафинистые нефти с содержанием 7-27% твёрдых парафинов.
Основная их масса содержится в мазуте, при перегонке которого углеводороды с числом углеродных атомов от 17 до 35 попадают в масляные дистилляты, а С36-С55 остаются в гудроне. По химическому составу углеводороды, выделенные из масляных фракций, составляют более 75% нормальных алканов и небольшие количества циклоалканов и разветвлённых углеводородов. Они имеют температуру плавления 45-54 0С, температуру кипения до 550 0С, плотность 0,860-0,940 и молекулярную массу 300-500. Твёрдые углеводороды с числом углеродных атомов от 36 до 55 носят название церезины. В состав церезинов входят алканы нормального и изостроения, которые могут содержать в молекуле циклоалкановые и ароматические структуры. Церезины имеют температуру плавления 65-88 0С, температуру кипения выше 600 0С, молекулярную массу 500-750. По внешнему виду похожи на воск.
Парафины легко кристаллизуются в виде пластинок и пластинчатых лент. Церезины же кристаллизуются в виде мелких игл, поэтому они не образуют прочных застывающих систем, как парафины.
В нефти парафины находятся в растворённом и взвешенном состоянии. На холоде растворимость их в нефти и нефтяных фракциях невелика, но при нагревании около 40 0С парафины неограниченно растворяются в них. Так как в недрах Земли повышенная температура, то в нефтях парафины находятся в растворённом состоянии, выделяясь из них в виде твёрдой фазы при подъёме нефти на поверхность. Поэтому при содержании их в нефти в пределах 1,5-2 % парафины отлагаются в скважинах и промысловых нефтесборных трубопроводах, затрудняя эксплуатацию скважин и транспорт нефти.
Парафины и церезины имеют разнообразное применение в химической промышленности, в производстве вазелина, в пропитке древесины, аппретировании тканей, в качестве изолирующего материала в электро- и радиотехнике.
Парафины применяют в качестве загустителя в производстве пластических смазок. Особенно большое значение они имеют, также как и жидкие алканы, для производства синтетических жирных кислот и спиртов.
Циклоалканы
Циклоалканы или цикланы – углеводороды, содержащие в молекуле циклы (кольца), построенные из атомов углерода (карбоциклические соединения), связанные между собой σ-связью. Цикланы входят в состав алициклических соединений. Общая формула циклоалканов CnH2n. Следовательно, молекулы цикланов, не имеющие заместителей, состоят из связанных между собой и замкнутых в кольца групп СН2 (метиленовая группа); отсюда и другое их название – полиметиленовые соединения.
В технической литературе (в том числе и в нефтяной) циклоалканы называют нафтенами. Последнее название им дал В.В. Марковников, впервые открывший эти углеводороды в 1833 году в бакинских нефтях.
Циклоалканы по числу циклов в молекуле подразделяются на моноцикланы (общая формула СnН2n), бицикланы (СnН2n-2) и полицикланы (СnН2n-4, СnН2n-6 и т.д.).
Дата добавления: 2016-12-09; просмотров: 4569;











