Химические свойства магнитных материалов
К группе магнитных материалов, прежде всего, относят элементы триады железа: железо, кобальт и никель. Химические свойства этих элементов определяются положением их в периодической системе. Атомы Fe, Co и Ni имеют по два
4s - электрона и соответственно 6, 7 и 8 электронов в 3d - подуровне. Например, у Fe 4s2 3d6 заполнение электронами 3d - ячеек сказывается на уменьшении степеней окисления при переходе от Fe к Ni. Максимальная степень окисления у железа +6, у кобальта +4 и у никеля +3. Чаще всего железо проявляет степень окисления +2 и +3, никель +2, кобальт +3 в простых соединениях и +3 - в комплексных. Очевидно, не все электроны незаполненного 3d - подуровня участвуют в валентных связях. Для Fe, Co и Ni характерно образование комплексных соединений.
Чистые металлы семейства железа прочные и пластичные. Стандартные электродные потенциалы для Fe, Co и Ni соответственно равны -0,441, -0,277 и -0,250 В. Разбавленная соляная, серная и азотная кислоты растворяют эти металлы, переводят их в Э2+ - ионы. При взаимодействии с соляной и серной кислотами металлы вытесняют водород, а реакция с азотной кислотой идет по уравнению
4Fe + 10HNO3 = 4Fe (NO3)2 + NH4NO3 +3H2O
Более концентрированная HNO3 и H2SO4 при нагревании окисляют железо до Fe (III) (выделяются NO или O2), например:
Fe + 4HNO3 = Fe (NO3)3 + NO + 2H2O
Очень концентрированные H2SO4 и HNO3 при комнатной и более низкой температуре пассивируют эти металлы, образуя на их поверхности оксидные пленки. В щелочных растворах все три металла достаточно коррозионностойкие. С водой в обычных условиях они не реагируют, но при температуре красного каления железо вступает во взаимодействие с парами воды:
3Fe + 4Н2O = Fe3O4 + 4Н2
При комнатной температуре на воздухе никель окисляется медленно, кобальт и железо быстрее. При накаливании они сгорают, образуя оксиды Fe2O3, CoO и NiО. Железо образует также оксиды FeO, Fe3O4, FeO3 и FeO4. Последние два очень неустойчивы. FeO4 получен в виде раствора в ССl4 путем извлечения тетраоксида экстракцией ССl4 из щелочных водных растворов, образующихся при анодном окислении железа:
Fe + 8ОH- - 8 ē = FeO4 + 4Н2O
Растворы FeO4 и ССl4 в обычных условиях разлагаются:
4FeO4 = 2Fe2O3 + 5O2
При сплавлении Fe2O3 в КОН и KNO3 образуются темно-красные ферриты (VI):
Fe2O3 + 4KOH + 3KNO3 = 2K2FeO4 + KNO2 + 2H2O
По своей окислительной способности они превосходят такой окислитель, как KMnO4 (E 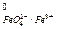 = 1,9 В > E
= 1,9 В > E  = 1,51 В).
= 1,51 В).
Кобальт образует оксиды СоО, СоО2 и Со3O4. Самый устойчивый из них СоО. Никель образует оксиды NiО и Ni2О3. Из гидроксидов наибольшее значение имеют Э (ОH)2 и Э (ОH)3.
Некоторые признаки амфотерности имеют Со (ОН)3 и Fe (ОН)3
Формулы таких оксидов, как FeO, CoO и NiО весьма условны, т. к., как правило, имеют нестехиометрический состав. Например, исследование состава вюстита FeO показало, что имеет вакансии в подрешетке железа, и его состав должен быть выражен формулой Fe1 - xO. Состав вюстита в стандартных условиях близок к Fe0,95O. С ростом значения X уменьшается пи-
киометрическая плотность. Для сохранения электронейтральности необходимо, чтобы на каждую вакансию Fe2+ приходилось два Fe3+ - иона в решетке. Эти более высокозаряженные ионы можно рассматривать как дырки, так как при малой энергии активации к ним могут перемещаться электроны от соседних Fe2+ - ионов, и положение Fe3+ - ионов нелокализовано. Этот положительный заряд диффундирует по кристаллу, что свойственно дырке. Такого же рода дырочными полупроводниками являются Сo1 - xО, Ni1 - xО и др.
Гидроксид Fe (OH)2 - более сильное основание, чем Fe (OH)3, соли железа (II) обладают более ионным характером, чем соли железа (III). Последние заметнее гидролизуются, чем соли Fe (II).
Fe (OH)2 легко окисляется на холоде кислородом воздуха:
4Fe (OH)2 + 2Н2O + O2 = 4Fe (OH)3
Ni (OH)3 получается действием сильных окислителей на Ni (ОH)2:
2Ni (OH)2 + Сl2 + 2NaOH = 2Ni (OH)3+ 2NaCl.
Взаимодействие соляной кислоты с Ni (OH)3 и Fe (OH)3 идет следующим образом:
Fe (OH)3 + 3HСl = FeCl3 + ЗН2О
2Ni (OH)3 + 6HCl = 2NiCl2 + Cl2 + 6H2O
Соли никеля (II) зеленого цвета; соли кобальта (II) - синие, а их растворы и кристаллогидраты розовые, соли железа (III) - бурые.
Железо, кобальт и никель поглощают водород, но определенных соединений с ним не дают. Нитриды их неустойчивы, но образуясь на поверхности стальных изделий при насыщении их азотом в атмосфере аммиака делают эти изделия более коррозионно устойчивыми и белее твердыми.
Железо, кобальт и никель образуют карбиды типа Э3С. Сульфиды типа ЭС получаются действием сульфида аммония (NH4)2 S на растворы солей и сухим путем.
Железо образует устойчивые цианиды:
FeCl2 + 2KCN = Fe (CN)2 + 2KCl.
Аналогично получают Fe (CN)3. При действии на эти цианиды избытком KCN получают комплексные соли гексацианоферрит (II) калия K4 [Fe (CN)6] - желтая кровяная соль и гексацианоферрат (III) K3 [Fe (CN)6] - красная кровяная соль. Эти соли являются специфическими реактивами на ионы Fe3+ и Fe2+:
4Fe3+ + 3 [Fe (CN)6] 4- = Fe4 [Fe (CN)6] 3
берлинская лазурь
3Fe2+ + 2 [Fe (CN) 6] 3- = Fe3 [Fe (CN)6] 2
турнбулева синь
Эта реакция очень чувствительна и используется для открытия Fe3+ - иона.
Чувствительной реакцией на ионы Ni2+ является взаимодействие с диметилглиоксимом (реактив Чугаева), в результате которой раствор окрашивается в яркорозовый цвет.
Особо интересными соединениями являются карбонилы металлов этого семейства. Атомы железа имеют четыре свободных места для электронов в подуровне 3d и шесть мест в подуровне 4р. Под давлением 107 Па и при 200 °С быстро об-разуется жидкий пентакарбонил железа: Fe + 5CO = Fe (CO)5, в котором атомы углерода - доноры электронов, атомы железа - акцепторы пяти пар электронов. Для такого взаимодействия необходима перегруппировка электронов в 3d - подуровне,
требующая некоторой энергии активации. Атомы никеля могут принять только 8 электронов в те же подуровни, поэтому образуется карбонил состава Ni (CO)4.
При 250 °С карбонил железа разлагается, чем пользуются при получении чистейшего железа для электро - и радиотехнических целей. Карбонил никеля разлагается при 200 °С, а тет-ракарбонил кобальта еще менее устойчив.
Дата добавления: 2016-12-09; просмотров: 1879;











