Основные стехиометрические законы химии
Стехиометрия - раздел химии, в котором рассматриваются массовые и объемные отношения между реагирующими веществами. Основу стехиометрии составляют стехиометрические законы: сохранения массы веществ, постоянства состава, кратных отношений, объемных отношений, Авогадро. Они подтвердили атомно-молекулярное учение.
Закон сохранения массы веществ.Впервые он был высказан М.В. Ломоносовым (1748 г.), а затем экспериментально обоснован в 1756 г.: масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции. М.В. Ломоносов рассматривал закон сохранения массы веществ и закон сохранения энергии в единстве, как всеобщий закон природы или, используя современную терминологию, как закон сохранения материи, который может быть сформулирован следующим образом: в изолированной системе сумма масс и энергии есть величина постоянная. Вторая часть этого закона утверждает, что åEi = const. Взаимосвязь массы и энергии выражается законом Эйнштейна: DE = Δmc2, где DE - изменение энергии; Dm - изменение массы вещества; c - скорость света в вакууме.
Исходя из закона сохранения массы, можно составлять химические уравнения и по ним производить расчет. Он является основой химического анализа.
Закон постоянства состава.Во времена М.В. Ломоносова химические соединения считались определенными, т.е. имеющими постоянный и неизменный состав. Это нашло отражение в законе постоянства состава, открытого в 1801 г. Прустом: каждое химически чистое соединение независимо от метода его получения обладает определенным элементарным составом. Например, аммиак можно получить двумя способами: а) N2 + 3H2 ® 2NH3; б) NH4Cl ® NH3 + HCl. Независимо от способа получения его молекулярный состав всегда постоянен, т.е. на один атом азота приходится 3 атома водорода.
Этот закон полностью выполняется для газообразных и жидких веществ, имеющих молекулярную структуру. Но многие кристаллические вещества: оксиды, селиниды, нитриды, карбиды, фосфиды и т.д. построены не из молекул, а из атомов. Для них удается установить только простейшие формулы, т.е. определить только простейшее отношение числа атомов элементов в веществах по процентному содержанию. Эти отношения часто оказываются изменяющимися в известных пределах в зависимости от условий получения веществ, поэтому в их формулах появляются дробные индексы, например, TiO0,7, TiO1,9. Такие соединения имеют переменный состав, который зависит от условий получения (например, состав оксида титана (II) - от температуры и давления кислорода, применяемого при его синтезе).
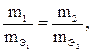 |
Закон эквивалентов.В результате работ Рихтера, Дальтона и Волластона (1804 - 1814 гг.) был установлен закон: все вещества реагируют в эквивалентных отношениях
где m1 и m2 - массы первого и второго вещества;  и
и 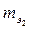 - эквивалентные массы первого и второго вещества.
- эквивалентные массы первого и второго вещества.
Химическим эквивалентом называют реальную или условную частицу вещества, которая может замещать, присоединять, высвобождать или быть каким - либо другим способом эквивалентна одному иону водорода в кислотно - основных или ионно - обменных реакциях или одному электрону в окислительно - восстановительных реакциях. Например, эквивалентом гидроксида калия и соляной кислоты будут соответственно КОН и НСl, серной кислоты - ½ H2SO4, фосфорной - ⅓ H3PO4, хлорида титана - ¼ TiCl2.
Эквивалентной массой называется масса одного эквивалента вещества; измеряется в г/моль. Например, эквивалентная масса NaOH равна 40 г/моль.
Закон кратных отношений.Этот закон формулируется следующим образом: если два элемента образуют несколько соединений друг с другом, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся между собой как небольшие целые числа. Например, на 1 г азота в разных его оксидах приходится 0,57; 1,4; 1,71; 2,28; 2,85 г кислорода, что соответствует отношению 1 : 2 : 3 : 4 : 5. Это отношение обусловлено числом атомов кислорода, которое приходится на каждые два атома азота в молекулах:
N2O, 2NO, N2O3, 2NO2 « N2O4, N2O5
Закон Авогадро (1811 г.)формулируется следующим образом: в равных объемах различных газов при одинаковых физических условиях (температуре и давлении) содержится одинаковое число молекул.
В 1856 г. Жераром были установлены следствия из закона Авогадро. Первое следствие: 1 моль любого газа имеет равный объем при одинаковых физических условиях. Этот объем можно вычислить, если известна масса 1 л газа. При нормальных условиях, т.е. при 273,15 К и 101325 Па, масса 1 л водорода равна 0,09 г, молярная масса молекулярного водорода равна 2,0158 г/моль. Тогда объем, занимаемый 1 моль водорода, будет: 2,0158 г/моль: 0,09 г/л = 22,4 л/моль. Этот объем называется молярным объемом газа.
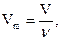 |
Итак, молярный объем газа - это отношение объема вещества к количеству этого вещества:
где Vm - молярный объем газа; V - объем вещества системы;
n - количество вещества системы.
Пример записи: Vm газа = 22,4 л·моль-1.
Второе следствие: молярная масса вещества в газообразном состоянии равна его удвоенной плотности по водороду.
М = 2,0158 ∙ 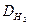 ,
,
где M - молярная масса газа; 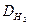 - плотность газа по водороду.
- плотность газа по водороду.
Часто плотность газа определяют по отношению к воздуху (Dвозд).
Хотя воздух является смесью газов, все же говорят о его средней молярной массе. Она равна 29 г/моль.
Дата добавления: 2016-12-09; просмотров: 15079;











