Первые модели строения атома
В соответствии с атомно-молекулярным учением до конца X1X века считалось, что атом является неделимой и устойчивой частицей. Это находило подтверждение во множестве химических реакций, в которых вещества реагировали между собой в определенных массовых отношениях, пропорциональных массам целых атомов. Однако изучение различных физико-химических явлений ставило под сомнение незыблемость атомно-молекулярного учения. Благодаря электрохимическим исследованиям, проведенным Петровым (1804 г.) и Дэви (1807 г.), а также установленным Фарадеем (1830-1834 г.г.) законам электролиза стало очевидным, что атомы могут нести положительный или отрицательный заряд.
С развитием спектральных методов анализа был установлен ряд количественных закономерностей, которые составили основу теории строения атома. Так, для спектра испускания водорода в видимой области Бальмером (1885 г.) было установлено определенное соотношение между частотами спектральных линий (серия Бальмера). В дальнейшем подобные соотношения были установлены Лайманом в ультрафиолетовой области и Пашеном – в инфракрасной.
Еще одним доказательством сложного строения атома послужило открытие в 1896 г. А. Беккерелем явления радиоактивности соединений урана. Позднее Пьер и Мария Кюри выделили из остатков руды после извлечения урана новый элемент – радий (Ra), радиоактивность которого оказалась в миллион раз выше радиоактивности урана.
Дальнейшие исследования явления радиоактивности, выполненные Э.Резерфордом, позволили обнаружить существование излучения трех видов – альфа (α)-, бета (β)- и гамма (γ)-лучей. Излучение каждого вида отличалось по своим электрическим свойствам и проникающей способности.
Дж. Томсон (1896 – 1897 г.г.) изучая природу катодных лучей, открытых Круксом (1879 г.), доказал, что они представляют собой поток электронов, вылетающих из катода со скоростью, близкой к скорости света. Он установил отношение заряда к массе электрона (ē/m), которое позднее было использовано для определения массы электрона и его заряда. В 1909 г. Малликен определил заряд электрона (ē = 1,6021·10-19 Кл), измеряя действие электрического поля на скорость падения капелек масла под действием силы тяжести. Подставив это значение в найденное Томсоном отношение заряда электрона к его массе была определена масса электрона (m = 9,1091·10-31 кг).
Первая модель, основанная на опытных данных, которые указывали на сложность строения атома, была предложена в 1904 г. Дж. Томсоном. В соответствии с этой моделью атом рассматривался как облако положительно заряженных частиц с распыленными в нем электронами. Однако оставалось неясным, что представляют собой частицы несущие положительный заряд. Последующие открытия начала XX века опровергли эту модель атома.
Продолжая исследовать природу явления радиоактивности Резерфорд установил, что радиоактивное излучение радия состоит из a- частиц (т.е. ядер гелия 2Не), которые выбрасывают ядра 88Ra, самопроизвольно распадаясь и превращаясь в ядра 86Rn. Эти частицы имеют заряд +2. β – излучение представляет собой поток электронов. В единицах заряда электрона каждая β- частица имеет заряд –1. γ – лучи представляют собой излучение высокой энергии, подобное рентгеновским лучам, открытым в1896 г. Рентгеном.
Открытие электрона и явление радиоактивности подтвердило идею о том, что атомы химических элементов представляют собой сложные системы, состоящие из более простых веществ.
В последующих экспериментах для изучения структуры атома Резерфорд использовал a- частицы (рис. 1). Результаты исследований (1911 г.) позволили отказаться от модели, предложенной Томсоном. Его эксперимент заключался в бомбардировке тонкой золотой фольги потоком быстрых a- частиц (He2+). Регистрация a- частиц проводилась с помощью флуоресцирующего экрана из сернистого цинка. Большинство частиц (~99 %) проходили через пластинку без отклонения и только некоторые (одна частица из 105) подвергались действию отклоняющей силы, а иногда даже отбрасывались на угол больше 90º. На основании полученных данных и математических расчетов Резерфорд предложил следующее строение атома: с одной стороны ядро, состоящее из протонов и нейтронов, в котором сконцентрированы масса и положительные заряды; с другой стороны электроны, вращающиеся в периферийной зоне на значительном расстоянии от ядра. Центробежная сила противодействует силе притяжения электронов ядром. Таким образом, атом напоминает солнечную систему в миниатюре.
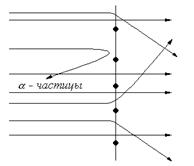
Рис. 1. Пути прохождения a- частиц через золотую фольгу
Резерфорд рассчитал размеры ядра атома: его диаметр равен приблизительно 10-12 см, тогда как диаметр атомов порядка 10-8 см.
Существенным недостатком в теории Резерфорда явилось то, что она не могла объяснить причину устойчивости атомов, поскольку из его теории следует, что электрон, двигаясь по окружности, будет непрерывно терять энергию (в виде электромагнитных волн) непрерывно приближаясь к ядру. Кроме того, эта теория не могла объяснить существование линейчатых спектров для атомов.
Объяснение спектра водорода и других атомов было дано датским физиком Нильсом Бором в 1913 г.
Модель Бора для атома водорода. Н. Бор разработал теорию строения атома водорода, используя модель Резерфорда и квантовый постулат Планка (1900 г.), который предложил теорию, основанную на предположении, что энергия не излучается атомами непрерывно, а испускается отдельными мельчайшими неделимыми порциями - квантами, величина которых зависит от частоты излучаемого света, а именно Е = hn, где Е - энергия кванта; h – постоянная Планка, равная 6,62·10 -34 Дж·с; n - частота колебаний, равная отношению скорости света с к длине волны λ (n = с/λ). Это уравнение называется уравнением Планка. Оно выражает один из основных законов природы. Согласно этому уравнению энергия тела может меняться на величины, кратные hn, подобно тому, как электрический заряд может меняться лишь на величину, кратную заряду электрона. Излучая квант света, атом переходит из одного энергетического состояния в другое.
Из формулы Планка следует, что свет с большей частотой электромагнитных колебаний состоит из больших квантов энергии. Кванты энергии впоследствии назвали фотонами. Фотоны являются особенными частицами, так как масса покоя их равна нулю и движутся они со скоростью, равной скорости света в вакууме. При малых частотах n у фотонов преобладающую роль играют волновые свойства, при больших n - корпускулярные свойства света.
Теория строения атома Бора была основана на следующих постулатах.
Первый постулат: в изолированном атоме электрон движется по круговым стационарным орбитам, находясь на которых он не излучает и не поглощает энергии. Каждой такой орбите отвечает дискретное, вполне определенное значение энергии (Е1, Е2, Е3 …, Еn , где n - целое число, отвечающее возможным стационарным состояниям электрона);
Второй постулат: переход электрона из одного стационарного состояния (Е2) в другое (Е1) сопровождается испусканием кванта монохроматического (l = const) излучения.
Если длина круговой орбиты радиусом r равна 2pr, то условие устойчивости орбиты следующее:
nl = 2prn,
где rn – радиус орбиты, на длине которой укладывается nдлин волн, n = 1, 2, 3… Целое число n было названо квантовым числом орбиты. Подставив значение l (длина волны электрона), можно определить значение rn – радиус внутренней орбиты атома. Для атома водорода он обычно называется боровским радиусом и обозначается символом а0=r1 = 0,053 нм. Радиусы других орбит определяют из соотношения rn = n2∙a0. Переход электрона с одной орбиты на другую, связанный с поглощением или испусканием фотонов, квантов энергии, получил название квантового перехода. Квантовое состояние с наименьшей энергией Е1 называется нормальным или основным, остальные квантовые состояния с большими уровнями энергии называются возбужденными. Фотон возникает в процессах перехода из возбужденного состояния в состояние с меньшей энергией; фотон исчезает, когда электрон после взаимодействия с ним переходит в состояние с большей энергией.
Для одноэлектронного атома (атома водорода) Бор показал, что потенциальная энергия электрона (Еn) на стационарных орбитах равна:
En= -13,6 (1/n2)
где Еn – потенциальная энергия, кДж/моль; n – целые числа равные 1,2,3….
Модель Бора позволила объяснить спектр атома водорода, состоящий из нескольких серий линий, частоты которых
удовлетворяют эмпирическому соотношению Ридберга:
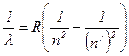 ,
,
где R – постоянная Ридберга (R = 109678 см-1);
n и n´ – целые числа, причем n < n´.
Серия линий, открытых Бальмером в видимой (10-5 см) области спектра соответствует n = 2; n´ = 3, 4, 5…
Теории Бора были свойственны и другие существенные недостатки. Самый большой из них – внутренняя нелогичность. С одной стороны она опирается на классическую механику, а с другой, отбрасывая законы классической электродинамики, привлекает квантовую теорию для объяснения строения атома. Оставался неясным и ряд вопросов, связанных с самими постулатами Бора, например: где находится электрон в переходе с одной орбиты на другую? Ни один физический процесс не может распространяться быстрее, чем скорость света. Поэтому при переходе с одной орбиты на другую электрон должен какое-то время находиться между ними, а это “запрещается” самой теорией. Теория Бора не пригодна для объяснения тонкой структуры линейчатого спектра атома водорода. Поэтому модель Бора уступила место новой теории строения атомов, так называемой квантовой механике или волновой механике.
Дата добавления: 2016-12-09; просмотров: 4430;











