Электрохимические источники тока.
Это устройства, позволяющие осуществлять непосредственное превращение химической энергии в электрическую.
Химические источники тока делятся на 3 группы:
1. Первичные источники тока
2. Вторичные источники тока (аккумуляторы)
3. Электрохимические генераторы.
I. элемент Лекланше (сухой марганцово-цинковый элемент).
Zn │NH4CL │ MnO2 + C │ C ЭДС = 1,5 – 1,8 В
В р-р NH4CL добавляют муку или крахмал, и некоторые соли (Zn и Cl2, СаCl2). Угольный стержень окружён MnO2 + C │ Zn – 2е → Zn 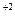

токообразная реакция │ Mn 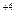 +1→ Mn
+1→ Mn 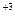

Применяется для питания радиоаппаратуры магнитофонов, карманных фонарей.
Широко известны воздушно-цинковые элементы (элемент «крона ВЦ»)
Zn │NaOH│ O2 (C)
С ЭДС = 1,4 В
Zn + NaOH + 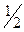 O2 = NaH Zn O2
O2 = NaH Zn O2
Первичные источники тока становятся непригодными после израсходования веществ, из которых они были выполнены.
Химические цепи.
Состоят из двух электродов, причем один из них обратим относительно катиона (электрод I рода), а другой относительно аниона.
Примером химической реакции являются различные аккумуляторы – накопители электрической энергии в виде химической. Они могут быть щелочными и кислотными.
Рассмотрим кислотный свинцовый аккумулятор:
Отрицательным полюсом (анодом) служит свинцовый электрод. Положительным полюсом (катодом) является электрод из диоксида свинца (PbO2), который в виде пасты заполняет ячейки свинцовой решетки. В качестве электролита используют 25 – 30% р-р серной кислоты.
(-) Pb, PbSO4
Сульфат свинцовый эл-д обратимый, относит. аниона SO4 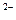
| H2SO4 25÷30 % | PbO2, Pb (+)
Свинцовоокисный H3O 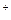 кислоты кислоты
|
Аккумуляторы – гальванические элементы, допускающие многоразовое использование.
Токообразующие вещества в аккумуляторах могут образовываться при пропускании через аккумулятор постоянного электрического тока от другого источника. Процесс регенерации активных веществ называют зарядом аккумулятора.
Дата добавления: 2016-11-26; просмотров: 2454;











