Цитоплазматическая наследственность
Наряду с ядерными генами, локализованными в хромосомах, обнаружены факторы наследственности, находящиеся в цитоплазме. Их называют плазмагенами (плазмидами). Химическую основу плазмагенов составляют молекулы ДНК; ДНК содержат пластиды, митохондрии и некоторые другие органоиды. В цитоплазме могут находиться также чужеродная ДНК вирусов и плазмиды бактерий. Внеядерная ДНК способна реплицироваться независимо от репликации хромосом, но под контролем ядерных генов. Цитоплазматическое наследование идет по материнской линии, т. е. через цитоплазму яйцеклетки, так как сперматозоид почти не содержит ее. Возможными критериями цитоплазматической наследственностиявляются:
▪ отсутствие количественного менделевского расщепления в потомстве;
▪ невозможность выявления сцепления;
▪ различие результатов реципрокных скрещиваний.
Выделяют следующие основные виды цитоплазматической наследственности: пластидную, митохондриальную и псевдоцитоплазматичес-
кую.
Открытие пластидной наследственности принадлежит К. Корренсу (1908), описавшему пестролистность у растения "ночная красавица". У пестролистных растений часть пластид неспособна образовывать хлорофилл. Пластиды при митозе распределяются между дочерними клетками неравномерно. Часть клеток получает только нормальные пластиды (листья будут зеленые), часть — только аномальные (листья будут белые, растение без хлорофилла погибнет) и часть — нормальные и аномальные пластиды (листья будут пестрые — зеленые с белыми пятнами) (рис. 3.20).
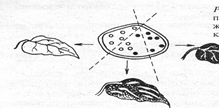
Рис. 3.20. Схема распределения пластид, содержащих и не содержащих хлорофилл,
при делении клетки
Митохондриальная наследственность описана Б. Эфрусси (1949). Он обнаружил, что около 1% хлебных дрожжей дают карликовые колонии. Оказалось, что клетки карликовых колоний не имеют в митохондриях дыхательных ферментов вследствие мутации плазмагенов и поэтому растут очень медленно. Гены, кодирующие дыхательные ферменты, находятся в кольцевых молекулах ДНК митохондрий. Длина каждой такой молекулы — примерно 15 000 пар нуклеотидов. Расчеты показали, что объем собственной наследственной информации митохондрий недостаточен для воспроизведения всей совокупности РНК и белков органоида. Многие белки включаются в структуру митохондрий, будучи запрограммированными ядерными генами.
Генóм митохондрий человека представлен кольцевой молекулой ДНК, содержащей 16 569 пар нуклеотидов. В состав генома входят гены р-РНК, 22 различных т-РНК, субъединиц I, II и III оксидазы цитохрома с, субъединиц 6-АТФазы, цито-хрома b и 9 других пока не известных белков. ДНК митохондрий имеет очень мало некодирующих участков; транскрибируются обе ее цепочки. Имеются данные о том, что некоторые наследственные болезни человека обусловлены мутациями митохондриальных генов (митохондриальная цитопатия, болезнь Лебера, синдром Альморга и др.).
В цитоплазме бактерий обнаружены автономно расположенные плазмиды, состоящие из кольцевых молекул двухцепочечной ДНК. Они обусловливают устойчивость бактерий к лекарствам (антибиотикам), программируют синтез некоторых ядов (гемолизин, энтеротоксин). Плазмиды обеспечивают также обмен генетической информацией между микроорганизмами. Внехромосомные молекулы ДНК широко используются в генной инженерии, так как они способны включать генетический материал хромосом и переносить его в другие клетки.
Псевдоцитоплазматическая наследственность обусловлена попаданием в цитоплазму клеток участков чужеродной ДНК, т. е. своего рода внутриклеточным паразитизмом. Так, у некоторых линий мух дрозофил имеется повышенная чувствительность к углекислому газу. Установлено, что эта особенность обусловлена передачей через цитоплазму яйца особых вирусов.
У мышей описаны линии с "наследственной" предрасположенностью к развитию рака молочной железы. При детальном изучении этого явления оказалось, что предрасположенность передается не через половые клетки, а через молоко, в котором содержится вирус (фактор молока). Если новорожденных мышат "раковой" линии вскармливает самка "нормальной" линии, они остаются здоровыми. Если же мышат "нормальной" линии вскармливает самка "раковой" линии, то у последних развивается рак молочной железы.
Генная инженерия
На основании достижений молекулярной биологии, биохимии и генетики в последние десятилетия интенсивно развивается новое направление — генная инженерия, целью которой является конструирование генетических структур по заранее намеченному плану, создание организмов с новой генетической программой путем переноса генетической информации из одного организма в другой.
Методы генной инженерии были разработаны в 60-70-х годах прошлого столетия. Они включают следующие основные этапы:
▪ получение генетического материала;
▪ включение этого материала в автономно реплицирующуюся генетическую структуру (векторную молекулу) и создание рекомбинантной ДНК;
▪ введение рекомбинантных молекул ДНК в клетку-реципиент и включение ее в хромосомный аппарат;
▪ отбор трансформированных клеток, в геном которых включен переносимый ген.
В настоящее время применяют несколько способов получения генов для пересадки. Если полностью расшифрована последовательность нуклеотидов, то ген может быть синтезирован химическим путем. Впервые искусственный ген аланиновой т-РНК, состоящий из 77 пар нуклеотидов, был синтезирован индийским ученым Г. Корана (1970). В 1976 г. был синтезирован ген тирозиновой т-РНК, состоящий из структурной и регуляторной частей (промотор и терминатор), который при введении в бактериальную клетку нормально функционировал. Однако химическим способом удается синтезировать только небольшие по размеру гены прокариот.
Синтез сложных генов осуществляют с помощью процессов обратной транскрипции, в основе которых лежит метод ферментативного синтеза. Выделяют и-РНК, и на ней, как на матрице, с помощью фермента ревертазы синтезируют комплементарную ей нить ДНК, которую затем реплицируют (фермент ДНК-полимераза). Гены, синтезированные с помощью ревертазы, не имеют регуляторной части и промотора и вследствие этого не могут функционировать в животных клетках. При переносе в бактерию к структурным генам присоединяют промотор микробной клетки, после чего транскриптон начинает работать.
Выделять необходимые для пересадки гены можно с помощью ферментов рестриктаз. В 1974 г. были открыты ферменты рестриктазы, способные узнавать определенные последовательности нуклеотидов и делать симметричные, расположенные наискось друг от друга разрывы в цепях ДНК на равных расстояниях от центра узнавания. В результате на концах каждого фрагмента расщепленной ДНК образуются короткие одноцепочечные участки, называемые "липкими концами" (рис. 3.21).
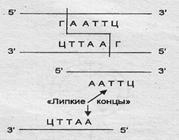
Рис. 3.21. Схема действия рестриктаз
К настоящему времени выделено свыше 200 различных рестриктаз, разрывающих молекулы ДНК с разной последовательностью нуклеотидов. Используя различные рестриктазы, удается выделять необходимые для пересадки гены.
Полученные различными способами гены соединяются с векторными молекулами, которыми могут служить плазмиды бактерий, липосомы, фаги и вирусы. Фаги и вирусы передают генетическую информацию посредством трансдукции. Кольцевая молекула ДНК плазмиды разрывается той же рестриктазой, что и выделяемый ген. В области разрыва образуются "липкие концы", комплементарные "липким концам" пересаживаемого гена. Фермент лигаза сшивает "липкие концы" гена и плазмиды. Получается рекомби-нантная молекула ДНК, которая обладает способностью проникать в клетку-реципиент. Комбинируя различные рестриктазы и лигазы, можно разрезать нить ДНК в разных местах и получать рекомбинантные молекулы (рис. 3.22).
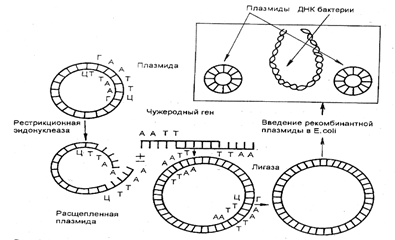
Рис. 3.22. Схема встраивания гена в плазмиду и введения
рекомбинантной плазмиды в бактерию
Так как рекомбинированные молекулы ДНК попадают не во все клетки, то с помощью специальных методов (чаще всего на селективных питательных средах) осуществляют отбор трансформированных клеток (с перенесенным геном). В дальнейшем проводят клонирование — размножение клеток с рекомбинантной ДНК — и получают клон клеток с заданными свойствами.
Объединение чужеродных генов в одной клетке чревато опасными последствиями. Плазмиды способны соединяться в любых комбинациях независимо от видовых и иммунологических барьеров. Конструирование новых разновидностей болезнетворных бактерий, устойчивых к лекарственным препаратам, может привести к возникновению серьезных эпидемий. В 1973 г. была проведена первая международная конференция по предупреждению опасных последствий генной инженерии. Опыты на время были запрещены. В 1975 г. Р. Кертис получил мутант кишечной палочки, нежизнеспособный в естественных условиях в связи с нарушением синтеза оболочки. Безопасная для человека и животных бактерия может жить только в лабораторных условиях. Это позволило возобновить опыты по генной инженерии. Такие исследования проводятся в специальных строго изолированных лабораториях с обязательным соблюдением определенных мер безопасности.
Дальнейшее развитие генной инженерии базируется на следующих достижениях молекулярной биологии:
▪ возможность вызывать с помощью химических мутагенов специфичес-
кие мутации в определенных генных локусах;
▪ возможность передавать генетическую информацию у эукариот неполо-
вым путем (трансформация или трансдукция), что позволит проводить генную терапию соматических заболеваний;
▪ возможность заменять дефектные гены, используя в качестве перенос-
чиков вирусы, липосомы и др.;
▪ возможность включать в геном человека искусственно синтезированные гены.
Генная инженерия — интенсивно развивающееся и перспективное направление генетики. Методами генной инженерии в промышленных масштабах уже получены клоны клеток кишечной палочки, способные продуцировать соматотропин, инсулин, интерферон и др. Обычно эти препараты получают из соответствующих тканей животных. Преимущество препаратов, полученных методами генной инженерии, заключается в возможности их синтеза в достаточных количествах, в биохимической чистоте и абсолютной стерильности.
Уже созданы растения, способные усваивать атмосферный азот, микроорганизмы, разрушающие углеводороды нефти и синтезирующие из них пищевые белки. Разработаны методы внесения генов патогенных вирусов в бактериальные клетки и приготовления из синтезированных ими белков противовирусных сывороток; проходят клинические испытания методы лечения некоторых опухолей (например, рака молочной железы), иммунодефицитных состояний и энзимопатий. В будущем генная инженерия поможет человечеству избавиться от ряда наследственных заболеваний путем пересадки зародышу недостающих генов или замены мутантных генов.
В настоящее время создаются банки генов человека, некоторых животных и растений.
Подробнее рассмотрим перспективы генной терапии человека. К концу 2001 г. в мире было утверждено свыше 400 генно-терапевтических проектов клинических испытаний методов лечения многих заболеваний человека.
Необходимо различать две разные цели генной терапии — коррекцию генетических дефектов в соматических клетках и коррекцию в зародышевых клетках или на самых ранних стадиях развития зиготы.
В настоящее время для переноса генов можно использовать клетки костного мозга, фибробласты и зародышевые клетки человека. Эти клетки можно извлечь из организма, культивировать, перенести в них нужный ген и снова ввести пациенту, в организме которого они будут размножаться. Наиболее перспективным является перенос нужных генов, связанный с использованием ретровирусов. Для того чтобы применять на практике генную инженерию, необходимо быть уверенным в ее безопасности. Например, человеческие про-тоонкогены по структуре отчасти сходны с нуклеиновой кислотой ретровирусов и при заражении ими клеток возможна модификация протоонкогенов и превращение их в онкогены.
В экспериментах на мышах проведена генная терапия на уровне зародышевых клеток: в оплодотворенные яйцеклетки мышей карликовой линии вводили гены гормона роста крыс. При этом только часть потомков (6 из 41) достигли гигантских размеров. Очевидно, что большинство введенных генов не подвергались нормальной регуляции, так как не удавалось внедрять их в места обычной локализации в хромосоме. Встраивание происходило в случайном порядке и в некоторых случаях это вызывало у мышей-реципиентов серьезные нарушения работы нормальных генов или их мутации в участках встраивания. По мнению большинства медицинских генетиков, метод генной терапии не следует в обозримом будущем применять к оплодотворенным клеткам человека, так как опасность изменения его генетической конституции слишком велика. По рекомендациям Всемирной организации здравоохранения ЮНЕСКО и Совета Европы временно приостановлено проведение экспериментов и клинических испытаний по трансгенозу зародышевых клеток человека.
Дата добавления: 2016-11-26; просмотров: 5280;











