ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
В лабораторных условиях микроорганизмы культивируют на питательных средах, поэтому питательная среда должна содержать все вещества, необходимые для их роста. Предложены сотни различных сред для культивирования микроорганизмов, состав которых определяется потребностями микроорганизмов в соединениях, необходимых для биосинтеза и получения энергии. Конструктивные и энергетические процессы у микроорганизмов крайне разнообразны, поэтому столь же разнообразны их потребности в питательных веществах. Из этогоследует, что универсальных сред, одинаково пригодных для роста всех без исключения микроорганизмов, не существует.
Основными компонентами любой питательной среды для культивирования микроорганизмов являются соединения углерода и азота. Иименно эти соединения определяют специфичность подавляющего большинства питательных сред.
По потребностям в углероде микроорганизмы принято делить на две большие группы - автотрофы и гетеротрофы.
Автотрофные микроорганизмы способны в качестве единственного источника углерода использовать углекислоту - соединение, содержащее углерод в наиболее окисленной форме. В соответствии с этим при культивировании автотрофов необходимо обеспечить клетки углекислотой, так как концентрация углекислоты в воздухе не превышает 0,03% и ее поступления в среду за счет диффузии недостаточно для интенсивного роста микроорганизмов. Поэтому в среды для культивирования автотрофов вносят бикарбонат натрия (NаНС 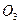 ) или карбонаты, чаще всего углекислый кальций (СаС
) или карбонаты, чаще всего углекислый кальций (СаС 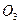 ). В некоторых случаях через среду продувают воздух, искусственно обогащенный 1-5% углекислоты.
). В некоторых случаях через среду продувают воздух, искусственно обогащенный 1-5% углекислоты.
Потребности гетеротрофных микроорганизмов не могут быть удовлетворены только углекислотой. Для их развития среда должна содержать органические соединения. В зависимости от индивидуальных особенностей микроорганизмы-гетеротрофы способны использовать различные соединения yглepoдa - кислоты, спирты, углеводы, углеводороды, ароматические соединения. При этом потребности некоторых микроорганизмов, например ряда бактерий из семейства Pseudoтonadaceae, могут быть удовлетворены широким набором различных органических веществ, тогда как другие микроорганизмы характеризуются высокой специализацией и способностью использовать лишь немногие соединения углерода, Так, некоторые метанокисляющие бактерии используют только метан и метанол.
Вторым основным компонентом питательной среды является источник азота. Азот входит в состав органических веществ клетки главным образом в восстановленной форме - в виде амино(-N 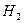 ) или имино(-NН)-групп. Тем не менее потребности микроорганизмов в источнике азота могут быть удовлетворены различными азотсодержащими соединениями, в которых азот имеет разную степень восстановленности. Для очень многих микроорганизмов это могут быть соли аммония. В этом случае в среды вносят N
) или имино(-NН)-групп. Тем не менее потребности микроорганизмов в источнике азота могут быть удовлетворены различными азотсодержащими соединениями, в которых азот имеет разную степень восстановленности. Для очень многих микроорганизмов это могут быть соли аммония. В этом случае в среды вносят N 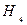 Cl или (N
Cl или (N 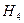 )
)  S
S 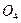 . Следует, однако, помнить, что аммонийные соли – физиологически кислые соли, так как по мере использования иона аммония в среде накапливается анион соответствующей кислоты. Что приводит к заметному возрастанию кислотности среды и может отрицательно повлиять на развитие микроорганизмов. Гидроксид аммония (NН
. Следует, однако, помнить, что аммонийные соли – физиологически кислые соли, так как по мере использования иона аммония в среде накапливается анион соответствующей кислоты. Что приводит к заметному возрастанию кислотности среды и может отрицательно повлиять на развитие микроорганизмов. Гидроксид аммония (NН 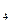 ОH) в качестве источника азота используют редко, пocкoльку он вызывает сильное подщелачивание питательных сред.
ОH) в качестве источника азота используют редко, пocкoльку он вызывает сильное подщелачивание питательных сред.
Потребности значительного числа микроорганизмов в азоте могут быть удовлетворены нитратами. Питательные среды для культивирования таких микроорганизмов содержат КNО 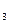 или NaNО
или NaNО 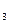 . В отличие от солей аммония нитраты - физиологически щелочные соли, так как при использовании аниона NО
. В отличие от солей аммония нитраты - физиологически щелочные соли, так как при использовании аниона NО 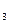 - в среде накапливаются катионы К+ или Na+. Нитриты в кислых условиях для многих микроорганизмов токсичны, поэтому в качестве источника азота почти не используются.
- в среде накапливаются катионы К+ или Na+. Нитриты в кислых условиях для многих микроорганизмов токсичны, поэтому в качестве источника азота почти не используются.
Питательные среды для культивирования микроорганизмов, более требовательных к азоту и соответственно обладающих меньшими биосинтетическими способностями, должны включать одну, несколько или полный набор аминокислот. Отдельные аминокислоты в L- или DL- форме добавляют к стерильной среде в концентрации от 0,1 до 0,05 г на 100 мл непосредственно перед засевом ее микроорганизмами. Для этого рекомендуется использовать растворы аминокислот, в которых концентрация превышает содержание аминокислоты в среде в 100 раз. Глицин, аланин, пролин, лизин и орнитин растворяют в дистиллированной воде, фенилаланин и триптофан - в дистиллированной воде, подщелоченной NaOH, остальные аминокислоты - в дистиллированной воде, подкисленной HCl. Аминокислоты - цистин и цистеин, а также амиды - глутамин и аспарагин неустойчивы к нагреванию, поэтому их стерилизуют фильтрованием. Остальные аминокислоты можно стерилизовать при 0,5 атм в течение 15 мин.
Потребности микроорганизмов в нескольких аминокислотах часто удовлетворяют, добавляя к среде гидролизат белка. Для получения гидролизатов используют белки животного (мясо, рыбу, желатину, казеин) или растительного (семена сои, подсолнечника) происхождения, а также клетки микроорганизмов (дрожжи, водоросли, бактерии). Гидролиз проводят с помощью протеолитических ферментов или кипячением с минеральными кислотами либо с терпкими щелочами. Состав гидролизатов неодинаков и зависит от исходного субстрата, а также способа получения. Чаще других используют гидролизат казеина, который готовят в лабаратории, как правило, кислотным гидролизом. Для этого 20 г казеина заливают 200 мл воды, добавляют 10 мл концентрированной H  SO
SO 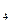 и выдерживают в автоклаве 4 ч при 1,5 атм. Однако при этом подвергается коррозии оборудование автоклава, поэтому чаще гидролизат казеина получают иначе. К 200 г казеина добавляют 280мл 6н раствора НСl, и смесь кипятят с обратным холодильником 18 ч. Полученный гидролизат нейтрализуют 50%-ным раствором NaOH до рН 7, фильтруют; через бумажный фильтр и стерилизуют при 0,5 атм 30 мин. Содержание аминного азота в гидролизате, полученном таким способом, составляет 700 – 1000 мг на 100 мл. Его добавляют к средам в таком количестве, чтобы концентрация по аминному азоту составляла 10-30 мг на 100 мл. Следует иметь в виду, чтопри кислотном гидролизе полностью разрушается триптофан, в достаточно большой степени цистеин и незначительно серин и треонин. Имеется готовый препарат гидролизата казеина. Его вносят в среды от 0,1 до 1,0 г на 100 мл в зависимости от потребностей микроорганизмов.
и выдерживают в автоклаве 4 ч при 1,5 атм. Однако при этом подвергается коррозии оборудование автоклава, поэтому чаще гидролизат казеина получают иначе. К 200 г казеина добавляют 280мл 6н раствора НСl, и смесь кипятят с обратным холодильником 18 ч. Полученный гидролизат нейтрализуют 50%-ным раствором NaOH до рН 7, фильтруют; через бумажный фильтр и стерилизуют при 0,5 атм 30 мин. Содержание аминного азота в гидролизате, полученном таким способом, составляет 700 – 1000 мг на 100 мл. Его добавляют к средам в таком количестве, чтобы концентрация по аминному азоту составляла 10-30 мг на 100 мл. Следует иметь в виду, чтопри кислотном гидролизе полностью разрушается триптофан, в достаточно большой степени цистеин и незначительно серин и треонин. Имеется готовый препарат гидролизата казеина. Его вносят в среды от 0,1 до 1,0 г на 100 мл в зависимости от потребностей микроорганизмов.
Наиболее требовательные микроорганизмы культивируют на питательных средах, содержащих белки или продукты их неполного расщепления- пептоны. Пептоны представляют собой смесь поли- и олигопептидов, аминокислот, органических азотных оснований, солей и микроэлементов. Их получают в результате воздействия протеолитических ферментов на белки животного (мышечный белок, казеин) или растительного (соевая мука) происхождения. В отечественных лабораториях чаще всего используют ферментативный пептон, выпускаемый Семипалатинским заводом. Это гигроскопический порошок светло-желтогоцвета, полностью растворимый в воде; 1 %-ный раствор пептона имеет нейтральную или слабокислую реакцию. В питательные среды пептон добавляют от 1-2 до 20 г на 1 л.
Необходимо иметь в виду, что аминокислоты и пептон микроорганизмы могут использовать не только как источник азота, но и как источник углерода и энергии.
Некоторые бактерии способны использовать в качестве единственного источника азота молекулярный азот - N  . Это азотфиксаторы. В среды для культивирования таких микроорганизмов соединений азота можно не вносить. Снабжение азотфиксаторов газообразным азотом осуществляется благодаря соприкосновению среды с воздухом или культивированию в атмосфере азота.
. Это азотфиксаторы. В среды для культивирования таких микроорганизмов соединений азота можно не вносить. Снабжение азотфиксаторов газообразным азотом осуществляется благодаря соприкосновению среды с воздухом или культивированию в атмосфере азота.
Помимо источников углерода и азота многие микроорганизмы требуют наличия в среде так называемых факторов роста, к которым относятся витамины, пурины, пиримидины и аминокнслоты. Для того чтобы подчеркнуть потребность, микроорганизмов в факторах роста, принято использовать термины «прототрофы» и «ауксотрофы». Прототрофы не нуждаются в факторах роста, для ауксотрофов абсолютно необходимо наличие в среде одного или нескольких факторов роста. Этими терминами особенно широко пользуются в литературе по генетике. Если потребности микроорганизмов в факторах роста ограничены одним или несколькими витаминами, то рекомендуется вносить их в культуральные среды, используя следующие концентрации: тиамин (витамин В 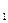 ), пантотенат Са, рибофлавин (витамин B
), пантотенат Са, рибофлавин (витамин B  ), никотиновая кислота (ниацин), пиридоксин, пиридоксамин, холин, кобаламин (витамин B
), никотиновая кислота (ниацин), пиридоксин, пиридоксамин, холин, кобаламин (витамин B 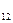 ) - по 1 мкг на 1 мл среды; фолиевая кислота и n-аминобензойная кислота - по 0,05 мкг на 1 мл среды; биотин - 0,005 мкг на 1 мл среды.
) - по 1 мкг на 1 мл среды; фолиевая кислота и n-аминобензойная кислота - по 0,05 мкг на 1 мл среды; биотин - 0,005 мкг на 1 мл среды.
Витамины добавляют к стерильной среде непосредственно перед ее засевом. Для этого рекомендуется использовать растворы, в которых концентрация витамина превышает его содержание в питательной среде в 100 раз. Paстворы готовят в стерильной посуде и используют стерильную дистилированную воду. Исключение составляют рибофлавин и фолиевая кислота. Рибофлавин растворяют в 0,02 н уксусной кислоте, а фолиевую кислоту - в 0,01 н NaOH, доводя затемконцентрацию NaOH в растворе до 0,001н. Полученные растворы стерилизуют прогреванием в кипящей водяной бане 3 мин. Раствор тиамина рекомендуется стерилизовать фильтрованием, так как при нагревании тиамин разрушается. При температуре +4 растворы витаминов сохраняются не менее месяца. Растворы фолиевой кислоты. пиридоксина и рибофлавина сохраняют в темноте, так как они светочувствительны.
Примерами смесей, содержащих факторы роста, могут служить дрожжевой экстракт, дрожжевой автолизат, а также кукурузный экстракт. Дрожжевой экстракт вносят в среду для культивирования от 0,05до 0,5 г на 100 мл, дрожжевой автолизат - в таком количестве, чтобы концентрация аминного азота составляла 5-30 мг на 100 мл среды. Дрожжевой экстракт
имеется в продаже. Дрожжевой автолизат готовят следующим образом: 40 г свежих прессованных или 10 г сухих дрожжей заливают водой и перемешивают до получения гомогенной массы, затем добавляют несколько кристаллов тимола или 1-2 мл хлороформа и выдерживают в термостате при 50-55 3 суток. За это время клетки дрожжей отмирают, а ферменты остаются активными и гидролизуют белки, а также другие биополимеры. Через 3 суток полученный автолизат после тщательного перемешивания кипятят на слабом огне 20 мин и фильтруют через бумажную пульпу, используя воронку Бюхнера. Содержание аминного азота определяют формальным титрованием. Дрожжевой автолизат стерилизуют при 0,5 атм 15 мин и сохраняют в холодильнике.
Кукурузный экстракт - готовый продукт заводов крахмало-паточной промышленности. Он содержит аминокислоты, витамины, достаточно большое количество органических кислот (молочной, уксусной и муравьиной) и минеральные соли. Кукурузный экстракт вносят в среды от 0,5 до 5 г на 10 мл; стерилизуют при 0,5 атм.
Кроме источников углерода, азота и факторов роста микроорганизмам для построения веществ клетки необходимы сера, фосфор и ряд других элементов. Все они должны содержаться в питательной среде в доступной для микроорганизмов форме. Потребности разных групп микроорганизмов в сере, фосфоре и других зольных элементах удовлетворяются обычно за счет минеральных солей. Поэтому так называемый «минеральный фон» сред для культивирования многих микроорганизмов может быть близким по составу. Так, потребности подавляющего большинства микроорганизмов в сере удовлетворяются сульфатами, хотя в клетке сера находится в основном в восстановленной форме, в виде сульфгидрильных групп. Значительно реже встречаются микроорганизмы, требующие наличия в среде восстановленной серы. В этом случае в среду вносят сульфиды, чаще всего Na  S, или органические соединения, содержащие сульфгидрильные группы, например цистеин.
S, или органические соединения, содержащие сульфгидрильные группы, например цистеин.
Соли фосфорной кислоты удовлетворяют потребности микроорганизмов в фосфоре. Все необходимые металлы - К, Na, Са, Mg, Fe, Мn, Co, Сu - и другие элементы микроорганизмы получают в форме катионов или анионов неорганических солей. Например, источником магния служит MgSO 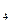 источником натрия и хлора - NaCl, кальция - СаСО
источником натрия и хлора - NaCl, кальция - СаСО 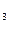 или CaCl
или CaCl  . Железо добавляют к средам в виде хлорида, сульфата или цитрата.
. Железо добавляют к средам в виде хлорида, сульфата или цитрата.
Для того чтобы избежать выпадения осадка в результате образования нерастворимых комплексов фосфатов с некоторыми катионами, особенно с железом и кальцием, к средам рекомендуется добавлять от 0,001 до 1 г/л этилендиаминтeтраацетат (ЭДТА) или гексаметафосфат натрия в концентрации 4 г/л. Комплексы, образуемые этими соединениями с катионами, служат резервом, из которого в результате диссоциации в раствор поступают свободные катионы.
Калий, магний, кальций и железо требуются в относительно больших количествах, поэтому их соли, как правило, включают в состав питательных сред. Потребности микроорганизмов в марганце, молибдене, цинке, меди, кобальте очень малы. Эти элементы, часто называемые микроэлементами, вносят в среды от 1 мгдo l мкг на 1 л; более высокие концентрации могут быть токсичны. Питательные среды с пептоном, почвенной вытяжкой, дрожжевым экстрактом, гидролизатом казеина содержат необходимые микроэлементы. В состав синтетических сред, которые готовятся на дистиллированной воде, их следует вносить. Об оптимальных концентрациях микроэлементов для разных микроорганизмов известно мало, поэтому предложены различные по составу смеси микроэлементов.
Смесь микроэлементов по Дрюсу (Drews, 1976), мг: ЭДТА Na-800; MnCl  *4H
*4H  O-10; CoCl
O-10; CoCl  *6H
*6H  O-4; CuSO
O-4; CuSO 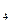 -1; Na
-1; Na  MoO
MoO 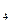 *2Н
*2Н  О - 3;ZnCl
О - 3;ZnCl  -2; LiCl - 0,5; SnCl
-2; LiCl - 0,5; SnCl  *2H
*2H  0;- 0,5; Н
0;- 0,5; Н 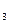 ВО
ВО 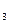 - 1, КВг-2; KJ -2; BaCl
- 1, КВг-2; KJ -2; BaCl  -0,5; вода дистиллированная-1000 мл; рН 6,0. На 1 л среды добавляют от 5 до 10 мл этого раствора.
-0,5; вода дистиллированная-1000 мл; рН 6,0. На 1 л среды добавляют от 5 до 10 мл этого раствора.
Cмесь микроэлементов по Пфеннигу (Pfennig, 1965), мг: ЭДТА-500;FeSO 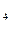 *7 H
*7 H  O-200; ZnSO
O-200; ZnSO 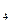 *7 H
*7 H  О-10; МnСl
О-10; МnСl  .4 H
.4 H  О-3; Н
О-3; Н 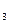 ВО
ВО 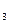 -30; CoCl
-30; CoCl  *2 H
*2 H  O - 20; CuCl
O - 20; CuCl  *2 H
*2 H  O - 1; NiCl
O - 1; NiCl  *6 H
*6 H  O - 2; Na
O - 2; Na  MoO
MoO 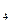 *2 H
*2 H  О - 3; вода дистилированная - 1000мл. На 1 л среды добавляют от 1 до 10 млэтого раствора. Растворы микроэлементов рекомендуется стерилизовать отдельно и вносить в среду непосредственно перед ее засевом.
О - 3; вода дистилированная - 1000мл. На 1 л среды добавляют от 1 до 10 млэтого раствора. Растворы микроэлементов рекомендуется стерилизовать отдельно и вносить в среду непосредственно перед ее засевом.
Питательные среды для культивирования микроорганизмов кроме соединений, необходимых для процессов биосинтеза, должны включать и энергетический материал. По способу получения энергии все микроорганизмы принято делить на две основные группы: хемотрофы и фототрофы.
Хемотрофы используют энергию окисления различных соединений. В зависимости от окисляемого субстрата (донора водорода) среди хемотрофных организмов выделяют хемолитотрофы и хемоорганотрофы. Первые окисляют неорганические соединения, такие как H  S, S
S, S 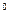 или другие не вполне окисленные соединения серы, H
или другие не вполне окисленные соединения серы, H  , NH
, NH 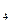 +, NO
+, NO  - или Fe
- или Fe 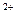 . Эти соединения в средах для культивирования хемолитотрофных бактерий выполняют прежде всего функцию энергетического материала. Для хемоорганотрофов энергетическим субстратом служат органические вещества, которые обычно играют двоякую роль, являясь одновременно и источником углерода и источником энергии. Однако есть микроорганизмы, которые для конструктивных и энергетических процессов нуждаются в разных соединениях. Например, гомоферментативные молочнокислые бактерии получают энергию при сбраживании сахаров, но почти не используют их в процессах биосинтеза. Для конструктивных целей им необходимы готовые аминокислоты, пуриновые или пиримидиновые основания, витамины.
. Эти соединения в средах для культивирования хемолитотрофных бактерий выполняют прежде всего функцию энергетического материала. Для хемоорганотрофов энергетическим субстратом служат органические вещества, которые обычно играют двоякую роль, являясь одновременно и источником углерода и источником энергии. Однако есть микроорганизмы, которые для конструктивных и энергетических процессов нуждаются в разных соединениях. Например, гомоферментативные молочнокислые бактерии получают энергию при сбраживании сахаров, но почти не используют их в процессах биосинтеза. Для конструктивных целей им необходимы готовые аминокислоты, пуриновые или пиримидиновые основания, витамины.
Фототрофы используют энергию света. Чтобы удовлетворить потребности этих бактерий в энергии, их культивируют при дневном или искусственном освещении.
По составу принято выделять естественные или натуральные среды неопределенного состава и синтетические среды.
Натуральнымиобычно называют среды, которые состоят из продуктов животного или растительного происхождения. К таким средам относятся овощные или фруктовые соки, животные ткани, разведенная кровь, молоко, воды морей, озер и минеральных источников, отвары или экстракты, полученные из природных субстратов, таких как мясо, почва, навоз, различные части растений, клетки микроорганизмов.
На натуральных средах хорошо развиваются многие микроорганизмы, поскольку такие среды содержат все компоненты, необходимые для роста и развития. Однако эти среды имеют сложный, непостоянный химический состав и малопригодны для изучения обмена веществ микроорганизмов, так как в них трудно учесть потребление ряда компонентов и образование продуктов метаболизма. Натуральные среды используются главным образом для поддержания культур микроорганизмов, накопления биомассы и для диагностических целей. К числу натуральных сред, широко применяемых в лабораторной практике, относятся мясо-пептонный бульон, неохмеленное пивное сусло, дрожжевая и картофельная среды, почвенный экстракт.
Мясо – пептонный бульон (МПБ). Основой для его приготовления служит мясная вода, которую обычно готовят следующим образом: 500 г мяса, освобожденного oт костей, жира и сухожилий, мелко нарезают или пропускают через мясорубку, заливают 1 л водопроводной воды и оставляют при комнатной температуре на 12 ч или в термостате при 30на 6 ч, а при 37 - на 2 ч. За это время из мяса экстрагируются различные вещества, в том числе водорастворимые витамины. Затем мясо отжимают через марлю, и полученный настой кипятят 30 мин. При этом свертываются белки. Остывшую массу фильтруют через ватный фильтр и доливают водой до первоначального объёма. Кмясной воде добавляют 1 % пептона и 0,5% NaCl.
МПБ - богатая питательная среда, но она почти не содержит углеводов. В случае необходимости их добавляют к МПБ чаще всего в количестве 1-2 г на 100 мл. МПБ стерилизуют при 1 атм.
Солодовое (неохмеленное пивное) сусло – хорошая среда для некоторых молочнокислых и уксуснокислых бактерий, дрожжей, микроскопических грибов и других представителей гетеротрофных микроорганизмов. Основные компоненты сусла - углеводы (до 90% от общей массы сухого остатка) и азотсодержащие соединения (до 6-7% от общей массы сухого остатка). Из углеводов в наибольшем количестве содержатся мальтоза и декстрины. В состав сусла входят витамины, преимущественно группы В, органические кислоты и минеральные соли.
Сусло готовят следующим образом. 250 г размолотого солода заливают 1 л водопроводной воды, нагревают до 48 - 50 и поддерживают эту температуру в течение получаса, непрерывно помешивая смесь, чтобы избежать образования комков. В последующие Полчаса температуру поднимают до 55-58 и поддерживают на этом ypовне до полного осахаривания крахмала, т. е до тех пор, пока реакция остывшей смеси с йодом будет отрицательной. При указанном режиме происходит также гидролиз белков до аминокислот и пептидов. Полученный экстракт фильтруют через бумажную пульпу или вату. В фильтрате определяют концентрацию caхapa, пользуясь ареометром Баллинга, градусы ( 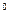 Б) которого примерно соответствуют процентному содержанию сахара в сусле. До нужной крепости сусло доводят водопроводной водой. Для культивирования микроскопических грибов чаще всего используют 3 – 4
Б) которого примерно соответствуют процентному содержанию сахара в сусле. До нужной крепости сусло доводят водопроводной водой. Для культивирования микроскопических грибов чаще всего используют 3 – 4 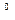 Б сусло, для дрожжей – 6-8
Б сусло, для дрожжей – 6-8 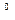 Б , а для наиболее требовательных молочнокислых бактерий – 8-12
Б , а для наиболее требовательных молочнокислых бактерий – 8-12 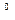 Б сусло. Сусло стерилизуют при 0,5 атм 30 мин.
Б сусло. Сусло стерилизуют при 0,5 атм 30 мин.
Дрожжевая среда используется в основном для культивирования ряда гетеротрофных микроорганизмов. Основа дрожжевой среды – дрожжевая вода. Для её приготовления 70 – 100 г свежих прессованных или 7 – 10 г сухих дрожжей 30 мин кипятят в 1 л воды и после осаждения клеток дрожжей жидкость декантируют или фильтруют через вату. К фильтрату добавляют 1 л воды, ещё раз 30 мин кипятят и вновь фильтруют. К 100 мл полученной дрожжевой воды добавляют 1-2 г углеводов и минеральные соли, чаще всего K  HPO
HPO 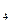 (0,1г) и NaCl (0,5 г). Доводят pH среды до 6,8-7,2. Среду стерилизуют при 0,5 атм 20 – 30 мин.
(0,1г) и NaCl (0,5 г). Доводят pH среды до 6,8-7,2. Среду стерилизуют при 0,5 атм 20 – 30 мин.
Картофельная среда используется в основном для культивирования спорообразующих бактерий, представителей рода Caulobacter и некоторых других хемоорганотрофных бактерий. Для приготовления этой среды 200 г тщательно вымытого и очищенного от кожуры и глазков картофеля нарезают мелкими ломтиками, заливают 1 л водопроводной воды и кипятят 20 - 30 мин. Отвар фильтруют через вату, доводят объем фильтрата до 1 л и разливают в сосуды для культивирования. Среду стерилизуют 1 ч при 1 атм или 30 мин при 1,5 атм.
Почвенный экстракт используют главным образом для культивирования разнообразных представителей почвенной микрофлоры. Для его приготовления 500 г плодородной почвы заливают 1,5 л водопроводной воды и автоклавируют при 1 атм 30 мин. Полученный экстракт фильтруют через бумажный фильтр, добавляют к горячему фильтрату 0,5 г СаСО 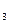 , тщательно перемешивают и через 5-7 мин фильтруют вновь. К экстракту, как правило, добавляют 0,2 г К
, тщательно перемешивают и через 5-7 мин фильтруют вновь. К экстракту, как правило, добавляют 0,2 г К  HPO
HPO 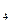 на каждые 1000 мл. Стерилизуют при 1 атм.
на каждые 1000 мл. Стерилизуют при 1 атм.
Синтетические среды - это среды, в которые входят лишь соединения определенного химического состава, взятые в точно указанных количествах. Синтетические среды широко используются при исследовании обмена веществ, физиологии и биохимии микроорганизмов. Для разработки состава синтетических сред, обеспечивающих рост микроорганизмов или усиленный биосинтез какого-либо продукта жизнедеятельности, необходимо знать особенности обмена веществ данного организма и потребности его в источниках питания. В настоящее время в распоряжении микробиологов имеется достаточное количество синтетических сред, не уступающих по своим качествам натуральным средам неопределенного состава. Синтетические среды могут иметь относительно большой набор компонентов, но могут быть, и довольно простыми по составу. Рецепты некоторых синтетических сред приведены в приложении.
Наряду с натуральными и синтетическими средами выделяют так называемые полусинтетические среды. Главными компонентами полусинтетических сред являются соединения известного химического состава – углеводы, соли аммония или нитраты, фосфаты и т. д. Однако в их состав всегда включаются вещества неопределенного состава, такие как дрожжевой автолизат, почвенный экстракт или гидролизат казеина. Эти среды находят широкое применение в промышленной микробиологии для получения аминокислот, витаминов, антибиотиков и других важных, продуктов жизнедеятельности микроорганизмов.
Следует иметь в виду, что среды, обеспечивающие хорошее развитие микроорганизмов вceгдa подходят для решения других исследовательских и практических задач, так как далеко не во всех случаях накопление какого либо продукта жизнедеятельности - фермента, витамина, антибиотика и т. д. идет параллельно накоплению биомассы.
Нередко при обильном росте микроорганизмов, желаемый продукт метаболизма почти не образуется или образуется в недостаточном количестве. Чтобы обеспечить необходимого соединения в максимально возможных количествах, применяются специальные среды. Подбор концентрации и соотношения компонентов среды осуществляют, используя методы математического планирования эксперимента, которые достаточно подробно изложены в книге В. Н. Максимова (1980).
Элективные среды предназначены для выделения микроорганизмов из мест их естественного обитания. Они обеспечивают преимущественно е развитие определённой группы микроорганизмов, для которой характерна общность физиологических свойств. Подробнее обэтих средах см. с. 108 – 109.
Дифференциально – диагностические (индикаторные) средыдают
Возможность быстро отличить одни виды микроорганизмов отдругих или выявить некоторые их особенности. Примером индикаторной среды для выявления бактерий из группы кишечной палочки в естественных субстратах служит агаризованная среда Эндо следующего состава, г: пептон- 10; лактоза-10; К  HPO
HPO 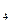 -3,5; NaHsO
-3,5; NaHsO 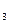 -2,5; агар - 150; вода дистиллированная – 1000 мл; pH 7,4. К среде добавляется 4 мл 10%-ного спиртового раствора основного фуксина. Среду стерилизуют при 1 атм 15 мин и сохраняют в темноте. Бактерии из рода Escherichia на этой среде образуют малиновые колонии с металлическим блеском.
-2,5; агар - 150; вода дистиллированная – 1000 мл; pH 7,4. К среде добавляется 4 мл 10%-ного спиртового раствора основного фуксина. Среду стерилизуют при 1 атм 15 мин и сохраняют в темноте. Бактерии из рода Escherichia на этой среде образуют малиновые колонии с металлическим блеском.
При определении видовой принадлежности бактерий используют pH-индикаторные среды, в состав которых входит один из индикаторов – нейтральный красный (0,0005%), феноловый красный (0,005%) или бромтимоловый синий (0,0005%). Если развитие микроорганизмов сопровождается образованием кислоты или щелочи, цвет индикатора изменяется, Дифференциально-диагностические среды особенно широко применяются в санитарной и медицинской микробиологии длябыстрой идентификации определенных групп микроорганизмов.
По физическому состоянию различают жидкие, сыпучие и плотные среды.
Жидкие средышироко применяют для накопления биомассы или пpoдуктов обмена, для исследования физиологии и биохимии микроорганизмов, а также для поддержания и сохранения в коллекции культур микроорганизмов, плохо развивающихся на плотных средах.
Сыпучие среды применяют главным образом в промышленной микробиологии для культивирования некоторых продуцентов физиологически активных соединений, а также в коллекциях для сохранения культур микроорганизмов. К таким средам относятся, например, разваренное пшено, отруби, кварцевый песок, пропитанный питательным раствором.
Плотные среды используют для выделения чистых культур, в диагностических целях для описания колоний, для определения количества микроорганизмов, их антибиотической активности, для хранения культур в коллекциях и в ряде других случаев. С целью уплотнения сред применяют агар или жeлатин. Плотной основой могут служить пластинки силиката, которые пропитывают питательной средой.
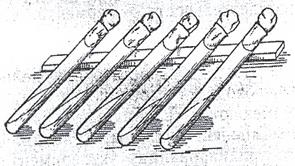
Рисунок 41. Приготовление скошенной агаризованной среды в пробирках
Агар используют для уплотнения сред особенно часто. Он представляет собой сложный полисахарид, в состав которого входит сахароза и агаропектин. Кроме того. Агар включает небольшое количество легко ассимилируемых веществ и различные соли. Агар получают из некоторых морских водорослей и выпускают в виде пластин, стебельков или порошка. Агар удобен тем, что большинство микроорганизмов не используют его в качестве субстрата для роста. В воде он образует гель, который плавится примерно при 100 °C и затвердевает при температуре 40°C.
Поэтому на агаризованных средах можно культивировать значительную часть известных в настоящее время микроорганизмов.
Чаще всего агар добавляют к средам в количестве 1,5%. Если необходимо получить более влажную среду, вносят 1,0%, а более плотную и сухую -2-3% агара. Среду с агаром нагревают на кипящей водяной бане до полного его расплавления. Если предполагают выращивать микроорганизмы на скошенной агаризованной среде в пробирках, то каждую пробирку заполняют средой не более чем на 1/3. Чтобы среда не подсыхала, ее скашивают после стерилизации, перед посевом. Для этого пробирки с расплавленной на кипящей водяной бане средой устанавливают в наклонном положении (рис. 41) и дают среде застыть. Скошенная агаризованная среда не должна доходить до ватной пробки на 4-6 см. Среду, предназначенную для культивирования бактерий в чашках Петри, разливают по 20-25 мл в пробирки большего объема, чем для скошенной агаризованной среды, или стерилизуют в колбах. В последнем случае до стерилизации агар не расплавляют.
При остывании агаризованных сред образуется конденсационная вода. Чем меньше концентрация агара, тем больше выделяется воды. Поэтому при выращивании микроорганизмов на поверхности агаризованных сред в чашках Петри с целью получения изолированных колоний чашки помещают в термостат крышками вниз. В противном случае на внутренней стороне крышки скапливается конденсат, который, стекая на поверхность среды, мешает получению изолированных колоний.
Агар имеет слабощелочную реакцию, поэтому его добавление может привести к незначительному повышению рН среды. В слабокислых, нейтральных или слабощелочных средах агар сохраняет способность образовывать гель после нескольких циклов плавления и затвердевания и даже после повторной стерилизации. Однако необходимо помнить, что при рН среды ниже 5,5 агар при стерилизации частично гидролизуется и поэтому теряет способность образовывать гель, т. е. не застывает. В этом случае его стерилизуют отдельно от среды в определенном объеме воды, расплавляют на водяной бане и приливают при постоянном перемешивании к стерильной, предварительно подогретой среде.
Агар, как указывалось выше, содержит примеси органических и минеральных веществ, которые иногда нежелательны. Чтобы избавиться от большинства из них, поступают следующим образом. Агар заливают водопроводной водой и ставят в термостат на 30-37. Примеси вымываются в воду и разлагаются под действием развивающихся в ней микроорганизмов. Через день-два жидкость сливают, агар промывают несколько раз свежей водой, снова заливают водой и вновь ставят в термостат. Когда и эта вода помутнеет, то ее опять заменяют новой, и так делают до тех пор, пока не исчезнет запах, а вода не перестанет мутнеть. Обычно через 2-3 недели получают агар, почти лишенный растворимых органических и минеральных веществ. Воду сливают, агар помещают в двойной марлевый мешок и 2-3 суток промывают проточной водопроводной водой, затем раскладывают его тонким слоем и просушивают на воздухе или в сушильном шкафу при 40-50.
Желатин - это экстракт, получаемый' из субстратов, богатых коллагеном - белком костей, хрящей, сухожилий, чешуи. Образуемый желатином гель плавится при температуре 25°С, которая ниже обычной температуры инкубации многих микроорганизмов (30 - 37°С). Кроме того, желатин разжижается протеолитическими ферментами, которые многие микроорганизмы выделяют в среду. Эти свойства желатина ограничивают его применение в качестве уплотняющего средства. Желатин используют главным образом в диагностических целях – для выявления протеолитической активности микроорганизмов, а также для получения гигантских и глубинных колоний дрожжей. В первом случае употребляют мясо – пептонный, во втором - сусловый желатин.
К жидким средам добавляют 10 – 20% желатин, оставляют набухать 5-10 мин и нагревают на водяной бане до растворения. Доводят рНсреды до 6,8-7,0.Желатин имеет кислую реакцию и обладает большой буферностью, поэтому на нейтрализацию идет больше щелочи, чем, например, на нейтрализацию МПА. Желатиновые среды стерилизуют при 0,5 атм 15 мин или дробно - 3 раза по 20 мин в кипятильнике Коха. Повторная стерилизация желатиновых сред, особенно при рН сред ниже 6,0 или выше 7,3 не рекомендуется, поскольку желатин частично гидролизуется и теряет гелеобразующие свойства.
Кремнекислый гель (силикагель) используют как твердую основу для синтетических сред строго определенного состава.
Гель готовят следующим образом. К соляной кислоте плотностью
1,1 добавляют при перемешивании равный объем раствора жидкого стекла (Nа  SiO
SiO 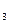 или К
или К  SiO
SiO 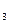 ) той же плотности., Смесь разливают в чашки Петри по 20-30 мл в каждую и оставляют чашки на горизонтальной поверхности на несколько часов до образования кремнекислого геля. Когда гель станет плотным, открытые чашки помещают в стеклянный или эмалированный сосуд, промывают 2-3 суток проточной водой для удаления хлоридов, а затем несколько раз горячей дистиллированной водой. Об отсутствии хлоридов судят по качественной пробе промывных вод с 1 – 5%-ным раствором азотнокислого серебра: при наличии хлоридов образуется белый осадок. Отмытые от хлора пластинки пропитывают 2-3 мл концентрированной среды, содержание компонентов в которой в 5-10 раз выше, чем в соответствующей жидкой среде. Затем чашки с гелевыми пластинками помешают открытыми в сушильный шкаф и подсушивают при 50-60, следя за тем, чтобы гель не растрескался и его поверхность осталась влажной. Если необходимо, чашки завертывают в бумагу и, не переворачивая, стерилизуют в автоклаве при 0,5 атм 15 мин. Пластинки, предназначенные для выделения и культивирования автотрофных бактерий, можно не стерилизовать. Стерилизуют только среду, которой пропитывают гель. Чашки с силикагелевыми пластинками сохраняют до употребления под водой.
) той же плотности., Смесь разливают в чашки Петри по 20-30 мл в каждую и оставляют чашки на горизонтальной поверхности на несколько часов до образования кремнекислого геля. Когда гель станет плотным, открытые чашки помещают в стеклянный или эмалированный сосуд, промывают 2-3 суток проточной водой для удаления хлоридов, а затем несколько раз горячей дистиллированной водой. Об отсутствии хлоридов судят по качественной пробе промывных вод с 1 – 5%-ным раствором азотнокислого серебра: при наличии хлоридов образуется белый осадок. Отмытые от хлора пластинки пропитывают 2-3 мл концентрированной среды, содержание компонентов в которой в 5-10 раз выше, чем в соответствующей жидкой среде. Затем чашки с гелевыми пластинками помешают открытыми в сушильный шкаф и подсушивают при 50-60, следя за тем, чтобы гель не растрескался и его поверхность осталась влажной. Если необходимо, чашки завертывают в бумагу и, не переворачивая, стерилизуют в автоклаве при 0,5 атм 15 мин. Пластинки, предназначенные для выделения и культивирования автотрофных бактерий, можно не стерилизовать. Стерилизуют только среду, которой пропитывают гель. Чашки с силикагелевыми пластинками сохраняют до употребления под водой.
Некоторые специфические особенности агара, желатин и кремнекислого геля суммированы в таблице 3.
Таблица 3.-Основные особенности веществ, употребляемых для уплотнения питательных сред 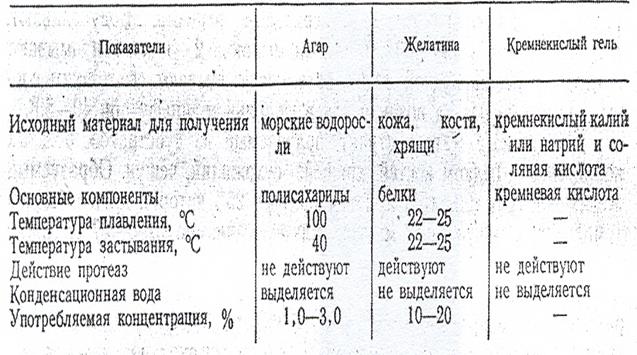
Следует помнить, что все среды с агаром или желатином следует относить к натуральным средам неопределенного состава.
Осветление сред. Осветленные агаризованные или желатиновые среды необходимы для некоторых специальных исследований, например для получения хорошо видимых изолированных колоний анаэробных микроорганизмов.
В ряде случаев прозрачную среду можнополучить, отфильтровав ее от осадка через гигроскопическую вату. Когда этого бывает недостаточно, среды осветляют с помощью белков куриного яйца. Для осветления 500 млсреды достаточно белка одного яйца. Бeлок отделяют от желтка и встряхивают с равным объемом воды до образования сплошной пены. Взбитый белок выливают в предварительно расплавленную и остуженную до 45-50 среду. Перед внесением белка проверяют рН и, если необходимо, подщелачивают среду до рН 7,0-7,3. Среду с белком тщательно перемешивают и прогревают при 100 в автоклаве или в кипятильнике Коха в течение часа. Белок св
Дата добавления: 2021-02-19; просмотров: 748;











