Способы культивирования анаэробных микроорганизмов
Выращивание анаэробных микроорганизмов более сложно, чем культивирование аэробов, так как соприкосновение культур анаэробов с кислородом воздуха должно быть сведено к минимуму или даже полностью исключено. Для этого используют различные приемы, нередко комбинируя их друг с другом.
Выращивание в высоком слое среды. Это наиболее простой способ ограничения доступа воздуха к культуре. Жидкую среду наливают в сосуды для культивирования высшим слоем. Так как нельзя стерилизовать среды, если они занимают более половины высоты сосуда, часть среды стерилизуют отдельно и стерильно доливают ею сосуд для культивирования сразу же после посева. Непосредственно перед посевом среду кипятят или прогревают на кипящей водяной бане 30-40 мин, затем быстро охлаждают, чтобы в ней не успел раствориться кислород воздуха, и вносят на дно посевной материал.
Если развитие микроорганизмов не сопровождается газообразованием, поверхность среды можно залить слоем стерильного вазелинового масла, парафина или их смесью (соотношение 1 : 3), слоем стерильного водного агара либо закрыть сосуды для культивирования стерильными пробками: стеклянной притертой или резиновой.
Культивирование в вязких средах. Диффузия кислорода в жидкость уменьшается с увеличением ее вязкости. Поэтому в вязких средах, таких как картофельная или среды с кукурузной либо другой мукой, хорошо развиваются некоторые облигатные анаэробы, например, возбудители маслянокислого или ацетонобутилового брожения. Вязкость жидких сред легко увеличить, если добавить к ним 0,2-0,3 % агара.
Выращивание в толще плотной среды. Этим приемом пользуются для получения изолированных колоний при выделении чистых культур или определении численности анаэробных микроорганизмов. Посевной материал вносят в расплавленную и остуженную до 48-50 агаризованную, желательно осветленную среду, тщательно перемешивают и оставляют в пробирках или переливают стерильной пипеткой в заранее простерилизованные трубки Бурри или чашки Петри. Поверхность среды в пробирках заливают парафином. Трубки Бурри – это стеклянные трубки, длиной 20-25 см, диаметром 1,0- 1,5см.Трубки стерилизуют, закрыв oба конца ватными пробками. Перед посевом ватную пробку уодного конца заменяют стерильной резиновой, через другой конец трубки вносят среду с посевным материалом и закрывают этот конец также резиновой пробкой (рис. 43).
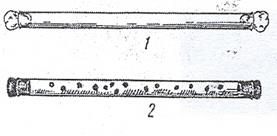
Рисунок 43. Трубка Бури: 1 – трубка. Подготовленная к стерилизации; 2 – колонии анаэробных микроорганизмов в толще агаризованной среды
При использовании чашек Петри для выращивания анаэробов засеянную агаризованную среду наливают в крышку чашки и, после того как среда застынет, плотно прижимают к ее поверхности дно чашки. Зазор между стенками дна и крышки, где среда соприкасается с воздухом, заливают стерильным парафином (рис. 44).

Рисунок 44. Культивирование анаэробов в чашке Петри: 1- агаризованная среда, 2 – парафин

Рисунок 45. Микроанаэростат
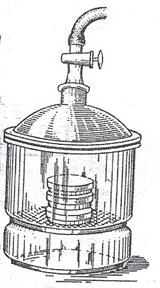
Рисунок 46. Стеклянный вакуумный эксикатор
Выращивание в анаэростатах. Анаэробные микроорганизмы можно выращивать в анаэростатах - вакуумных металлических камерах, снабженных манометром (рис. 45). Анаэростатом может служить обычный вакуумный стеклянный эксикатор (рис. 46). Из анаэростата откачивают воздух, а затем, как правило, заполняют его газовой смесью, состоящей из азота (90-80%) и углекислоты (10-20%)до давления порядка 67*10 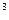 Па (500 мм рт. ст.). Избыточное давление исключает возможность диффузии кислорода воздуха. Для заполнения анаэростатов газовой смесью используют газометры (рис. 47). Газометр (А)заполняется отдельным газом или газовой смесью через кран 1. Жидкость, первоначально заполняющая газометр, через кран 2 (кран 3 при этом закрыт) вытесняется в сосуд Б. Затем кран 1 закрывают, осторожно открывают кран 3, и жидкость из сосуда Б поступает в газометр и вытесняет газ в анаэростат (В). Объем газа, заполняющего анаэростат, измеряют по объему жидкости, поступившей из сосуда Бв газометр. Необходимо помнить, что выпускаемые промышленностью газы даже высокой чистоты содержат, как правило, небольшие количества кислорода. Поэтому, чтобы очистить газы от остатков кислорода, их пропускают через химические поглотители, например, через колонки с раскаленной восстановленной металлической медью.
Па (500 мм рт. ст.). Избыточное давление исключает возможность диффузии кислорода воздуха. Для заполнения анаэростатов газовой смесью используют газометры (рис. 47). Газометр (А)заполняется отдельным газом или газовой смесью через кран 1. Жидкость, первоначально заполняющая газометр, через кран 2 (кран 3 при этом закрыт) вытесняется в сосуд Б. Затем кран 1 закрывают, осторожно открывают кран 3, и жидкость из сосуда Б поступает в газометр и вытесняет газ в анаэростат (В). Объем газа, заполняющего анаэростат, измеряют по объему жидкости, поступившей из сосуда Бв газометр. Необходимо помнить, что выпускаемые промышленностью газы даже высокой чистоты содержат, как правило, небольшие количества кислорода. Поэтому, чтобы очистить газы от остатков кислорода, их пропускают через химические поглотители, например, через колонки с раскаленной восстановленной металлической медью.
Для удаления кислорода из окружающей среды при культивировании анаэробов иногда используют вещества, поглощающие кислород. Эти вещества можно поместить на дно большой пробирки, имеющей специальную подставку, на которую ставят пробирку с бактериальной культурой . Удобно использовать специальные сосуды, во внешнюю расширенную часть которых вносят поглощающую смесь, а во внутреннюю - питательную среду с микроорганизмами. Культуральный сосуд закрывают ватной пробкой, а сосуд с поглотителем - резиновой, что обеспечивает герметичность системы (рис. 48). Применяют также вакуумные или обычные эксикаторы, в которые на дно или в специальные сосуды помещают поглощающие кислород вещества.
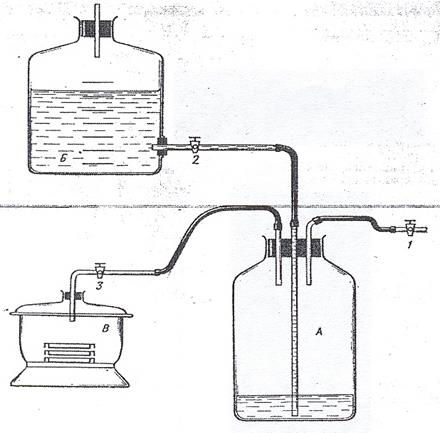
Рисунок 47. Газометр (А) и анаэростат (В)
В качестве поглотителя в лабораторной практике используют щелочной раствор пирогаллола, дитионита натрия (Na  S
S  O
O 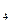 ), металлическое железо и некоторые другие реактивы. При этом необходимо учитывать поглощающую способность реактивов и объем замкнутого пространства, в котором выращивается культура. Например, на каждые 100 мл емкости используют 1 г пирогаллола и 10 мл 2,5 н. раствора гидроксида натрия. Поскольку
), металлическое железо и некоторые другие реактивы. При этом необходимо учитывать поглощающую способность реактивов и объем замкнутого пространства, в котором выращивается культура. Например, на каждые 100 мл емкости используют 1 г пирогаллола и 10 мл 2,5 н. раствора гидроксида натрия. Поскольку
многие анаэробы нуждаются в углекислоте для биосинтеза веществ клетки, пирогаллол растворяют не в щелочи, а в насыщенном растворе бикарбоната натрия. Полноту поглощения кислорода химическими веществами контролируют, используя раствор, содержащий окислительно-восстановительный индикатор. Для приготовления раствора смешивают равные объемы 0,024%-ного раствора NaOH, 0,015%-ного водного раствора метиленового синего и 6%-ного раствора глюкозы;
в качестве антисептика к раствору добавляют тимол. Перед употреблением в пробирку наливают 5 мл смеси и нагревают в кипящей водяной бане до обесцвечивания, быстро охлаждают и помещают в анаэростат. В анаэробных условиях раствор остается бесцветным.
Удобен в обращении анаэростат системы Газ Пак (Gas Pak), кoторый снабжен палладиевым катализатором, поглощающим кислород, и химическими генераторами водорода (таблетка борогидрида натрия - NaHB 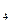 ) и углекислоты (таблетка бикарбоната натрия и лимонной кислоты). После загрузки анаэростата таблетки смачивают водой и тотчас герметически закрывают его крышкой. В таком анаэростате анаэробные условия создаются через 16-20 мин.
) и углекислоты (таблетка бикарбоната натрия и лимонной кислоты). После загрузки анаэростата таблетки смачивают водой и тотчас герметически закрывают его крышкой. В таком анаэростате анаэробные условия создаются через 16-20 мин.
Культивирование в средах с восстановителями. Рост многих облигатных анаэробов возможен только в средах с низким окислительно- восстановительным потенциалом (Eh). Поэтому в среды для культивирования анаэробов рекомендуется добавлять восстановители, например, цистеин, тиогликолевую кислоту или ее натриевую соль, сульфид натрия (Na  S), аскорбиновую кислоту или дитиотреитол. Чаще других используют сульфид и тиогликолат натрия. Обычно готовят 1 % -ные растворы этих восстановителей в 5% -ном растворе бикарбоната натрия, стерилизуют автоклавированием и добавляют к средам сульфид Na из расчета 250-500 мг, а тиогликолат натрия от 250 мг до 1 г на 1 л среды. Восстановители следует использовать в концентрациях, не влияющих на рост микроорганизмов.
S), аскорбиновую кислоту или дитиотреитол. Чаще других используют сульфид и тиогликолат натрия. Обычно готовят 1 % -ные растворы этих восстановителей в 5% -ном растворе бикарбоната натрия, стерилизуют автоклавированием и добавляют к средам сульфид Na из расчета 250-500 мг, а тиогликолат натрия от 250 мг до 1 г на 1 л среды. Восстановители следует использовать в концентрациях, не влияющих на рост микроорганизмов.
Рисунок 48. Сосуды для выращивания анаэробов: 1 – бактериальная культура, 2 – химический поглотитель молекулярного кислорода
Функции восстановителей выполняют и такие компоненты среды, как глюкоза и другие восстанавливающие сахара, а также пептон. С целью снижения окислительно-восстановительного потенциала к средам для культивирования анаэробов можно добавлять убитые клетки дрожжей, кусочки свежевырезанных тканей паренхиматозных органов животных (почки, печень, сердце) или растительных тканей (клубни картофеля, корнеплоды).
Степень поглощения кислорода и соответственно степень восстановленности среды определяется окислительно-восстановительным потенциалом - Eh, который измеряют электрометрически на потенциометре или с помощью индикаторов таких, как резазурин, феносафранин и нейтральный красный, изменяющих окраску при изменении Eh. Особенно удобен резазурин, который добавляют к средам в концентрации 0,0001 % и стерилизуют вместе с минеральными компонентами среды. В окисленной форме он окрашен в слабо-розовый цвет, восстановленная форма его бесцветна. Резазурин регистрирует окислительно-восстановительный потенциал выше - 420 В. Феносафранин регистрирует более низкие значения потенциала - 252 В.
Успешному выращиванию облигатных анаэробов способствует внесение в среду большого количества посевного материала. Это объясняется тем, что при развитии анаэробов в культуральной жидкости накапливаются восстановители, которые связывают часть растворенного кислорода новой среды.
Некоторые экстремальные анаэробы, к которым относятся, например, метанобразующие бактерии и микроорганизмы рубца, погибают даже при кратковременном соприкосновении с кислородом воздуха. Работа с такими микроорганизмами представляет большие трудности и требует специального оборудования. Техника работы с экстремальными анаэробами была разработана Хангейтом. Она включает совокупность нескольких приемов, главными из которых являются следующие:
- среды перед употреблением кипятят для освобождения от растворенного кислорода;
- к средам обязательно добавляют восстановители - цистеин,
сульфид Na, тиогликолат Na;
- пересевы, посевы, разлив сред в сосуды для культивирования
осуществляют в токе углекислоты или водородуглекислотной
смеси;
- культуры выращивают в герметически закрытых сосудах в атмосфере газовой смеси, часто с избыточным давлением;
- газы Н  , СО
, СО  или их смеси используют только после очистки от следов кислорода.
или их смеси используют только после очистки от следов кислорода.
В последнее время для культивирования экстремальных анаэробов предложены специальные камеры, которые содержат внутри все необходимое для выполнения бактериологических работ, включая термостат. Камера заполняется газовой смесью, состоящей из 10% Н  , 10% СО
, 10% СО  и 80% N
и 80% N  , освобожденной от примеси кислорода. Работу в камере исследователь проводит, надевая перчатки, вмонтированные в камеру. Это оборудование достаточно сложно и дорого, но оно имеет одно неоспоримое преимущество- контакт клеток микроорганизмов с воздухом исключается на всех этапах работы.
, освобожденной от примеси кислорода. Работу в камере исследователь проводит, надевая перчатки, вмонтированные в камеру. Это оборудование достаточно сложно и дорого, но оно имеет одно неоспоримое преимущество- контакт клеток микроорганизмов с воздухом исключается на всех этапах работы.
Температура
Интервалы температур, в которых возможен рост различных микроорганизмов, заметно варьируют. У мезофилов, к которым относится большинство известных нам форм, температурный оптимум лежит в интервале от 25 до 37°С. У термофилов он значительно выше - от 45 до 60-70°С. Психрофилы хорошо развиваются в интервале температур 5-10°С. Отклонения температуры от оптимальной неблагоприятно влияют на развитие микроорганизмов. Поэтому микроорганизмы выращиваются в термостатах (рис. 49) или специальных термостатированных комнатах, где с помощью терморегуляторов поддерживается соответствующая оптимальная температура. Мезофильные бактерии, естественным местом обитания которых является вода и почва, выращивают в интервале от 20 до 30°С, тогда как бактерии кожных покровов, слизистой или кишечника человека и животных культивируют при более высокой температуре – 35 – 37°С.
Для выращивания психрофилов используют холодильные камеры.
Свет
Для роста подавляющего большинства микроорганизмов освещение не требуется. Напротив, прямые солнечные лучи отрицательно влияют на их развитие. Поэтому такие микроорганизмы выращивают в темноте. Свет необходим для роста фототрофных микроорганизмов. Однако естественное освещение используют редко, так как оно непостоянно и плохо контролируемо. Как правило, фототрофы выращивают в люминостатах, то есть в камерах, освещенных лампами накаливания или флуоресцентными лампами дневного света. Необходимая температура в люминостатах создается благодаря вентиляции или холодильному устройству.
Выбор источника освещения определяется спектром его излучения и длинами волн, при которых осуществляют фотосинтез культивируемыe микроорганизмы. Для выращивания пурпурных и зелёных бактерий лучше использовать лампы накаливания; для культивирования микроводорослей и цианобактерий можно
Рисунок 49. Термостат для культивирования микроорганизмов
применять флуоресцентные лампы дневного света. Помимо спектрального состава света обращают внимание на интенсивность освещения, которую измеряют с помощью люксметра Ю-16.
Вода
Рост и размножение микроорганизмов невозможны без присутствия в окружающей среде воды, причем вода должна находиться в доступной для клетки форме, т. е. в жидкой фазе. Однако в природных субстратах и питательных средах часть воды ассоциирована с молекулами растворенных веществ и не может быть использована микроорганизмами. Доступность воды в субстрате для развития микроорганизмов выражают величиной активности воды (а 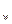 ). а
). а 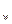 = Р/Р
= Р/Р  , где Р – давление пара раствора (мм рт. ст.), Р
, где Р – давление пара раствора (мм рт. ст.), Р  - давление пара чистой воды (мм рт. ст.) при данной температуре. Значение а
- давление пара чистой воды (мм рт. ст.) при данной температуре. Значение а 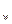 для дистиллированной воды равно 1,00. При растворении различных веществ в воде эта величина уменьшается и соответственно падает доступность для клетки воды.
для дистиллированной воды равно 1,00. При растворении различных веществ в воде эта величина уменьшается и соответственно падает доступность для клетки воды.
Микроорганизмы могут расти на средах со значеннем а 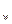 от 0,99 до 0,63. Потребности в доступной воде у бактерий, как правило, выше, чем у дрожжей и микроскопических грибов. Так, большинство бактерий, за исключением галофилов, хорошо растет на средах с вeличиной а
от 0,99 до 0,63. Потребности в доступной воде у бактерий, как правило, выше, чем у дрожжей и микроскопических грибов. Так, большинство бактерий, за исключением галофилов, хорошо растет на средах с вeличиной а 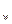 от 0,99 до 0,95, минимальная величина а
от 0,99 до 0,95, минимальная величина а 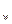 , обеспечивающая рост дрожжей, лежит в пределах от 0,91 до 0,88.
, обеспечивающая рост дрожжей, лежит в пределах от 0,91 до 0,88.
Активность воды в среде можно определить по формуле а 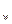 =А/100, где А - относительная влажность (%) атмосферы, которую измеряют при равновесии в закрытом сосуде, содержащем среду. Paзличную активность воды в питательной среде или субстрате создают добавлением к ним таких соединений, как NaCl, глюкоза, глицерин, полиэтиленгликоль, или уравновешиванием небольшого объема среды с большим объемом раствора H
=А/100, где А - относительная влажность (%) атмосферы, которую измеряют при равновесии в закрытом сосуде, содержащем среду. Paзличную активность воды в питательной среде или субстрате создают добавлением к ним таких соединений, как NaCl, глюкоза, глицерин, полиэтиленгликоль, или уравновешиванием небольшого объема среды с большим объемом раствора H  SO
SO 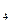 или солей NaCl, KCl, КNО
или солей NaCl, KCl, КNО 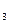 ), имеющих определенную активность воды.
), имеющих определенную активность воды.
ГЛАВА 5
ВЫДЕЛЕНИЕ ЧИСТЫХ КУЛЬТУР МИКРООРГАНИЗМОВ
Физиологию, биохимические свойства, циклы развития микроорганизмов исследуют, как правило, при работе с чистыми культурами. Чистой, или аксенической, культурой называют такую культуру, которая содержит микроорганизмы одного вида. Умение выделить микроорганизмы одного вида из смешанной популяции, существующей в природе, и поддерживать чистоту культуры - необходимое условие работы с микроорганизмами. Выделение чистой культуры обычно включает три этапа: получение накопительной культуры; выделение чистой культуры; определение чистоты выделенной культуры.
Дата добавления: 2021-02-19; просмотров: 905;











