Технология диффузионного легирования
ДИФФУЗИОННОЕ ЛЕГИРОВАНИЕ. Физические основы процесса
Математическое моделирование процессов диффузионного легирования развивалось на базе двух основных подходов:
- теории сплошных сред с использованием уравнений диффузии Фика;
- атомистической теории, основанная на взаимодействии между точечными дефектами (вакансиями и межузельными атомами) и примесными атомами.
При низких значениях концентрации примеси, при которых коэффициенты диффузии не зависят от концентрации примеси, решения уравнения диффузии Фика достаточно хорошо подтверждаются экспериментальными результатами.
При высоких значениях концентрации примеси форма диффузионных профилей отклоняется от модельных представлений. Введение в уравнения диффузии концентрационную зависимость коэффициента диффузии , например, аналитическое выражение Больцмана — Матано, приводит к адекватным результатам.
Для объяснения экспериментальных результатов зависимости коэффициентов диффузии от концентрации и для анализа других аномальных результатов процесса диффузии были предложены различные атомные модели, основанные на взаимодействии дефектов с примесными атомами.
Итак, при низкой концентрации примеси и низкой плотности дислокаций процесс диффузии может быть описан феноменологической теорией диффузии с использованием закона диффузии Фика с постоянным значением коэффициента диффузии. Математические выражения, отражающие процесс диффузии, получают путем решения уравнения диффузии Фика. При этом коэффициенты диффузии различных элементов определяют для разных температур. В случае высокой концентрации примеси концентрационная зависимость коэффициентов диффузии связана с предполагаемым механизмом или механизмами диффузионных процессов на атомном уровне.
Уравнения диффузии
В 1855 г. швейцарский физик А. Фик предложил теорию диффузии. В основу этой теории положена аналогия между процессами переноса массы в растворах и тепла в телах за счет теплопроводности. Согласно модели А. Фика (при отсутствии конвективного переноса) поток вещества (атомов) в одномерном направлении через единицу площади в единицу времени (кг/м2с) может быть определен из уравнения первого закона А Фика:
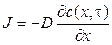 , (1)
, (1)
где c — концентрация растворенного вещества, которая, как предполагается, зависит только от координаты х и времени τ; х — ось координат, совпадающая с направлением потока вещества; D — коэффициент диффузии (м2/с).
Из уравнения (1) следует, что локальная скорость диффузионного переноса (растворенного) вещества пропорциональна градиенту концентрации этого вещества
В соответствии с законом сохранения вещества, изменение концентрации растворенного вещества со временем должно быть равно уменьшению диффузионного потока в том же объеме, где произошло изменение концентрации, т. е.
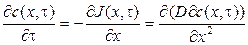 (2)
(2)
Это уравнение формализует второй закон Фикадля одномерного случая:
При низких концентрациях растворенного вещества коэффициент диффузии можно считать постоянным и уравнение (2) можно записать в виде
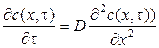 . (3)
. (3)
Решения уравнений диффузии.
Наиболее просто уравнения диффузии решаются для случая независимости коэффициента диффузии D от концентрации примеси/
В практике формирования p-n переходов диффузионное легирование проводят при двух граничных условиях:
- диффузия из неограниченного источника;
- диффузия из ограниченного источника.
В первом случае примесные атомы диффундируют из источника, нанесенного на поверхность кремниевой подложки. Такой источник поддерживает постоянную поверхностную концентрацию (Cпов = const) благодаря равенству потоков прихода и расхода диффундирующего компонента в течение всего процесса диффузии.
Во втором случае небольшое количество легирующего вещества (предварительно) осаждается на поверхность кремния. Это условие реализуется при использовании низкотемпературных процессов, например ионной имплантации, на первой стадии диффузионного процесса. Диффузия из ионно-имплантированных слоев может служить примером второго случая.
Ниже приведены решения диффузионного уравнения Фика для обоих случаев.
Диффузия из бесконечного источника.
Начальные условия
при τ = 0 и х >0 С (х,0) = 0 (4)
Граничные условия
при x =0 и τ ≥ 0 С (0,τ) = С пов (5)
x =  и τ > 0 С (
и τ > 0 С ( 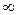 ,τ ) = 0 (6)
,τ ) = 0 (6)
Тогда решение уравнения (3), которое удовлетворяет начальным и граничным условиям, можно записать как
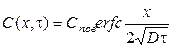 , (7)
, (7)
где Спов — постоянная поверхностная концентрация легирующией примеси, (м-3) ; D— постоянный коэффициент диффузии, (м2/с); х— расстояние по оси координат (м) с учетом, что х=0 находится на поверхности кремния; τ—время диффузии, (с); и erfc — дополнительная функция ошибок.
На рис. 5.2 приведен нормированный профиль концентрации для распределения примеси согласно дополнительной функции ошибок уравнение (7).
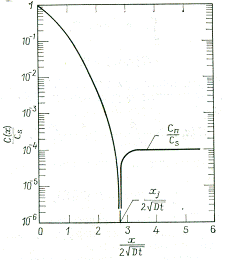
Рис.1 Нормированное распределение по дополнительной функции ошибок.
Глубина, на которой концентрация диффундирующей примеси равняется концентрации исходной примеси в подложке, называется металлургическим переходом хj . Выражение для вычисления глубины залегания диффузионного p – n перехода имеет вид:
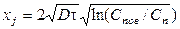 (8)
(8)
Для хj можно записать С(хj) = Сп, где Сп, — концентрация исходной примеси в подложке. Предполагая, что подложка легирована примесью противоположного (диффузанту) типа проводимости и используя для отображения концентрации логарифмическую шкалу, можно определить результирующую концентрацию легирующих элементов /СD — Сa/вблизи р—n перехода.
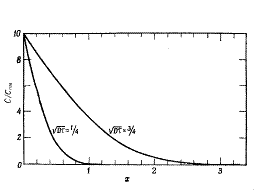 На рис. 2 показаны распределение примеси для двух различных значений времени диффузии.
На рис. 2 показаны распределение примеси для двух различных значений времени диффузии.
Рис.2 Диффузия легирующих элементов с поверхности постоянной концентрации
Чтобы С пов сохранялось постоянным, необходимо равенство потоков поступления вещества и его убыли.
Количество примесных атомов, поступивших в твёрдое тело за время τ равно
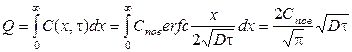 (9)
(9)
Диффузия из ограниченного источника.
Предположим, что на поверхности кремниевой подложки осажден тонкий слой (толщиной h) легирующего вещества с фиксированным или постоянным общим числом атомов. Приток диффузанта извне отсутствует. Кремниевая подложка, в которую проводится диффузия, легирована примесью противоположного типа проводимости с концентрацией Сп (м -3). Такие условия характерны для изготовления сплавно-диффузионных и эпитаксиальных структур.
В этом случае решение уравнения (3) проводится при следующих начальном и граничных условиях:
при τ = 0 и 0 ≤ х ≤ h С (х,0) = C пов (10)
при τ = 0 и h ≤ х ≤ 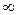 С (х,0) = 0 (11)
С (х,0) = 0 (11)
Решение диффузионного уравнения (3), которое удовлетворяет условиям (10), (11) будет следующее выражение:
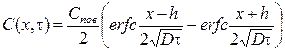 |
(12)
Вид этой функции показан на рис. 3 (при h =1).
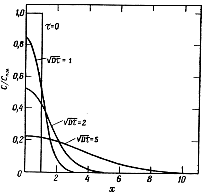 |
Рис. 3 Диффузия из ограниченного источника
При τ = 0 распределение негауссово для всех значений х; при 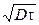 = 1 распределение гауссово для 0 < х < 1; при
= 1 распределение гауссово для 0 < х < 1; при 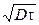 = 2 распределение гауссово для 0 < х < 4; при
= 2 распределение гауссово для 0 < х < 4; при 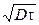 = 5 распределение гауссово для 0 < х < 25.
= 5 распределение гауссово для 0 < х < 25.
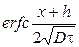 |
Если глубинна диффузии х << h , то →1 и распределение
примеси будет определяться следующей зависимостью:
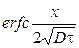 |
С(х,τ) = 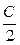 (13)
(13)
Данное распределение описывает диффузионный поток в эпитаксиальных структурах с толстыми слоями, когда h >> 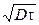 .
.
Диффузия из неограниченного источника проводится при изоляции полупроводниковых структур и формирования эммитерных областей.
Диффузия из ограниченного источника используется при создании многослойной структуры и формирования базовых областей транзисторов.
2.1.2. Анализ решений уравнений диффузии
Коэффициент диффузии
Из уравнений (7), (13) видно, что одним из основных факторов диффузионных процессов является коэффициент диффузии. Величина коэффициента диффузии определяется: энергией связи примесных атомов в решетке, плотностью вакансий в кристалле, постоянном кристаллической решетки и т.п. Связь коэффициента диффузии с температурой выражается законом Аррениуса
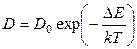 , (14)
, (14)
где ΔЕ – энергия активации, т.е. энергия, необходимая для элементарного скачка диффундирующего атома примеси в решетке кристалла, (Дж); D0 – константа материала, численно равная коэффициенту диффузии при бесконечной температуре (определяется экспериментально), (м2 /с); k - постоянная Больцмана, (Дж/К); Т – абсолютная температура диффузии, (К).
 Если проанализировать зависимость коэффициента диффузии от входящих в формулу переменных величин, то можно заметить, что изменение температуры всего на несколько градусов приводит к двух-трехкратному увеличению коэффициента диффузии, что, в свою очередь, приводит к существенному изменению глубины залегания легирующего слоя. Так, например, каждое увеличение температуры на 100 °С, начиная от 900 °С, приводит к росту коэффициент диффузии примерно в пять раз (рис.4.).
Если проанализировать зависимость коэффициента диффузии от входящих в формулу переменных величин, то можно заметить, что изменение температуры всего на несколько градусов приводит к двух-трехкратному увеличению коэффициента диффузии, что, в свою очередь, приводит к существенному изменению глубины залегания легирующего слоя. Так, например, каждое увеличение температуры на 100 °С, начиная от 900 °С, приводит к росту коэффициент диффузии примерно в пять раз (рис.4.).
Рис.4 Зависимость коэффициента диффузии примеси в кремнии от температуры
Исходя из вышесказанного, возникает крайняя необходимость поддержания температуры в зонах диффузии с точностью не хуже ± 0,5 градуса, что, например для В и Р , обеспечивает колебания глубины залегания примесей на уровне ± 1%.
Необходимость поддержания высоких температур диктуется также следующими обстоятельствами. Как известно, растворимость примеси в твердых телах и, в частности, в полупроводниках определяется видом примеси и температурой процесса. Чем выше температура, тем выше растворимость. При создании эмиттерной области транзисторов необходимо учитывать тот факт, что концентрация вводимой примеси должна быть порядка 1020-^1021 см~3. Такую величину концентрации можно достигнуть при высоких температурах (порядка 1000—1300 °С).
Время диффузии
Время проведения диффузионного процессе вместе с коэффициентом диффузии входят под знак экспоненты. Следовательно, изменение времени диффузии оказывает такое же влияние на характеристики p – n переходов как иизменена коэффициента дафнии. Поэтому с целью более жесткого контроля времена процесса диффузии необходимо устанавливать постоянными скорости загрузки / выгрузки пластин, а также использовать технологическую тару (лодочку) постоянной массы.
Растворимость примеси
Диффузионное легирование тесно связано с растворимостью примеси одного вещества в другом. Она характеризуется максимально возможной концентрацией примеси в твердом теле при данной температуре. Растворимость в твердой фазе определяет верхний предел концентрации примеси данного тала в полупроводнике. Требуемая максимальная концентрация примеси должна бить меньше растворимости этой примеси в данном полупроводниковом материале.
В таблице I приведены данные но предельной растворимости в кремнии наиболее распространенных элементов III ( акцепторы) и V (доноры) групп. периодической системы. Из представленных в таблице данных следует, что наибольшую растворимость в кремнии имеют фосфор, мышьяк (доноры) и бор (акцептор).
Качество поверхности.
Существенное влияние на диффузионные процессы и в особенности на распределение примесей в локальных областях внутри диффузионных зон оказывают совершенства кристаллической структуры полупроводникового материала и чистота его поверхности. Присутствие посторонних частиц или нарушений структуры на поверхности пластины могут привести к неравномерному распределению примесей, к образованию p – n переходов с различной глубиной залегания, а транзисторных структурах – к неравномерности толщины базы и изменению свойств транзисторов
Таблица. Предельная растворимость некоторых элементов в кремнии
| № п/п | Элемент | Температура | Предельная растворимость |
| - | - | К | атом / м3 |
| P | 1,3 1027 | ||
| As | 2,1 10 27 | ||
| Pb | 6,0 10 25 | ||
| Gr | 4,0 1026 | ||
| Al | 2,0 1026 | ||
| B | 6,0 10 26 |
Технология диффузионного легирования
Способы проведения
Процессы диффузионного легирования занимают сравнительно ограниченный диапазон температур. Для кремния, например, этот диапазон 1100÷1300°С или с учетом процесса загонки при двухстадийной диффузии 1000÷1300°С. Ниже 1000°С значения коэффициентов диффузии очень малы и глубина диффузии незначительна. Выше 1300°С качество диффузионных слоев неудовлетворительно вследствие нарушения поверхности пластин под действием температуры. Если в изолированный объем поместить пластину полупроводника и легирующий элемент и нагреть их до некоторой температуры, то вследствие сублимации или испарения легирующего элемента в объеме вскоре установится определенное парциальное давление его паров. Молекулы пара адсорбируются всеми поверхностями, в том числе и поверхностью пластины, и при достаточно большой температуре диффундируют вглубь. В общем случае равновесная концентрация пропорциональна давлению пара, поэтому управление поверхностной концентрацией примеси осуществляют путем контроля давления пара. Если равновесие на поверхности достигается за время, меньшее, чем длительность диффузии, то поверхностная концентрация остается постоянной. Поэтому в большинстве случаев распределение примеси при диффузии из газовой фазы описывается функцией дополнения к интегралу ошибок.
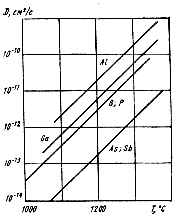
Диффузионные процессы проводят в проточной или замкнутой системе. В проточной диффузионной системе выходной конец диффузионной трубы сообщается с атмосферой (рис. 5, а ,б, в, д). Через него в зону диффузии загружают кремниевые пластины . Чтобы свести к минимуму воздействия атмосферы, над выходом трубы 2 устанавливают вытяжную систему. Входной конец диффузионной трубы 3 служит для введения газа-носителя (азота, аргона или кислорода). Иллюстрацией замкнутой системы является диффузия в герметизированной ампуле (рис.5., г). Пластины полупроводника 1 и источник
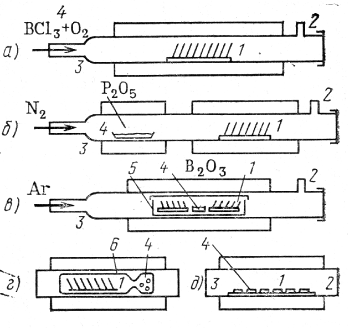
Рис. 5 Схемы методов диффузионного легирования:
а,б,в,д, - проточная система;
зг г – замкнутая система
диффузанта 4 загружают в кварцевую ампулу 6, которую вакуумируют, герметизируют и помещают в диффузионную печь 5. Диффузант 4 либо наносят на поверхность пластины (рис. 5., д), либо вводят в виде пара или газа в газ-носитель (рис. 5., а). На рис. 5., б показана схема двухзонной печи, применяемой в основном для диффузии из твердых источников диффузанта методом открытой трубы, а на рис. 5., в — схема бокс-метода. В последнем методе пластины и источник примеси находятся в полугерметичном контейнере 5 однозонной печи.
Наиболее широкое распространение получила диффузия в проточной, открытой системе, проводимая из твердых, жидких и газообразных источников.
Основными диффузантами при диффузии в кремний являются фосфор и бор.
При изготовлении планарных приборов процесс диффузии обычно проводят в две стадии. На первой стадии (загонке) на поверхности кремния создают тонкий диффузионный слой с erfc-распределением примеси. Загонку осуществляют в печах с одной или двумя температурными зонами при невысоких по сравнению с собственно диффузией температурах. На второй стадии (разгонке) пластины полупроводника нагревают в однозониой печи в атмосфере, не содержащей .атомов диффузанта, так что единственным процессом является диффузионное перераспределение примеси. Вторая стадия соответствует диффузии из источника с ограниченным содержанием примеси. Двухстадийная диффузия имеет два основных преимущества перед одностадийной:
1) разделение процесса на две стадии делает его более управляемым, что повышает воспроизводимость и упрощает его контроль;
2) облегчается маскирование, так как первая стадия кратковременная и относительно низкотемпературная, а на второй стадии нет паров диффузанта.
Все это вместе повышает стойкость и защитные свойства диоксида кремния.
Диффузанты.
В процессах диффузионного легирования используются следующие диффузанты:
газообразные – гидриды: бора – диборан (B2H6); фосфора – фосфин (РН3); мышьяка – арсин (AsH3); сурьмы – стибан (SbH3)
жидкие - галогениды бора, фосфора, мышьяка;
твердые - оксиды бора, фосфора, мышьяка и сурьмы.
Наиболее распространенным источником фосфора при диффузии из твердого источника является обезвоженный пентаоксид фосфора (фосфорный ангидрид Р2О5). Навеску Р2О5 помещают в зону источника и нагревают до 230—300°С (рис. 5., б). Газ-носитель захватывает молекулы пентаоксида и переносит их в зону диффузии. Между кремнием и Р2О5 происходит химическая реакция, в результате которой выделяются элементарный фосфор и оксид кремния, образующие стеклообразное соединение на поверхности пластины, из которого и происходит диффузия. Ряд желательных характеристик имеет жидкий источник фосфора (оксихлорид фосфора РОСl3). Он не гигроскопичен, имеет малый расход, стабилен по концентрации фосфора при длительном использовании. Механизм диффузии из жидкого источника аналогичен диффузии из Р2О5, так как жидкие источники реагируют с избыточным кислородом, образуя Р2О5. На поверхностную концентрацию влияют расход РОСl3, температура источника, диаметр диффузионной трубы, конструкция отражателя паров и состав газа-носителя. Как правило, по воспроизводимости и возможности регулирования параметров системы с источником в жидкой фазе лучше, чем системы с источником в твердой фазе. С тем же успехом используют трихлорид РС13 и пентафторид фосфора PF5.
В системах диффузии фосфора в открытой трубе из газообразного источника обычно используют фосфин РНз. Механизм диффузии из РНз такой же, как и из Р2О5, поскольку он превращается в фосфорный ангидрид в результате окисления, когда поступает в нагретую диффузионную камеру. Для регулирования поверхностной концентрации применяют разбавление РНз инертным газом. Фосфин не поглощает воду. С помощью этой системы можно получить низкую поверхностную концентрацию, однако управление концентрацией затрудняется вследствие неконтролируемого поглощения кварцевыми трубами ангидрида фосфора.
Самым распространенным источником в твердой фазе, используемым для диффузии бора в открытой трубе, является борный ангидрид В2О3. В зоне источника бора диффузионной трубы поддерживается температура порядка 900°С. При соприкосновении борного ангидрида с кварцем происходит расстекловывание и кварц становится непригодным к употреблению. Для устранения недостатков В2О3 ( или Н3ВО3) смешивают с SiO2, используя метод совместного осаждения из тетраэтилорто-силиката SiO (СН3СН2)4. Это позволяет регулировать поверхностную концентрацию в широких пределах.
Наиболее распространенный источник в жидкой фазе, используемый в системах диффузии бора в открытой трубе,— это трехбромистый бор ВВгз. Поверхностной концентрацией управляют, изменяя температуру диффузии, температуру источника и расход потока газа-носителя.
Наиболее удобным источником для управления процессом диффузии являются гидриды легирующих элементов. В качестве примера рассмотрим использование В2Н6. Диборан используют в восстановительной или нейтральной среде в разбавленном (Ar, N2, H2) виде, содержащем до 0,05% диборана. При Т > 300 0С происходит пиролиз В2Н6 с образованием элементарного бора. Лучшей воспроизводимостью обладают системы с окислительной средой, содержащей до 0,01% В2Н6 и до 2,5 % 02 в аргоне или азоте. Диборан взаимодействует с кислородом, образуя борный ангидрид и воду. Присутствие воды значительно увеличивает скорость испарения борного ангидрид, что обусловливает равномерное распределение диффузанта вдоль рабочей зоны вследствие образования летучих борных кислот, особенно метаборной НВО2. Недостатками В2Н6, как и всех гидридов, являются токсичность и легкая воспламеняемость на воздухе при концентрациях более 0,8%
На рис.6 представлены температурные зависимости коэффициентов диффузии В, Al, P и As в кремнии.
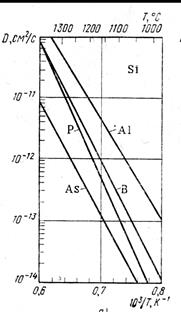 |
Рис. 6. Зависимость коэффициентов диффузии примесей в кремнии
Следует отметить, что при использовании сухих инертных газов и водорода наблюдается эрозия поверхности кремния. При использовании азота и наличии высокой температуры наблюдается образование нитридов, которые выпадают на поверхность.
Однако использование слабоувлажненных инертных газов или сухого кислорода приводит к хорошим результатом. Причиной тому, является образование на поверхности кремния тонкой пленки окисла, которая препятствует эрозии, но пропускает диффузант. Затем, при последующем травлении в плавиковой кислоте, она удаляется, и поверхность кремния остается гладкой.
В случае высокой влажности окисная пленка частично растворяется в парах воды и хуже осуществляет защиту поверхности. Влажность паров регулируется температурой воды в увлажнителе (барботере). Влажность газа-носителя оказывает также влияние на скорость испарения ряда диффузантов.
Преимущество данного метода — хорошая воспроизводимость, а его недостаток — трудность получения высокой поверхностной концентрации (выше 1018 см-3) и наличие в той или иной степени эрозии поверхности кремния.
Чтобы полностью избежать поверхностной эрозии чистые элементы IIIили V группы заменяют их окислами, в результате чего диффузия идет из стекловидных слоев, образующихся на поверхности. Особенно хорошие результаты это дает в случае применения соединений В2О3 и Р2О5.
Взаимодействие окислителя с кремниевой подложкой приводит к образованию слоя окисла SiO2. Упрощённо механизм диффузионного дегирования может быть представлен следующей схемой. Окислитель и примесь, содержащиеся в газовой фазе (при легирования из внешнего источника), адсорбируются окислом, растворяются в нем и взаимодействуют между собой, образуя примесно-силикатное стекло.
n P2O5 + m SiO2 → P2nSimО5n + 2m
В результате образуется двухслойная плёнка: стекло - двуокись кремния. Граница раздела этой двухслойной системы постепенно перемещается идостигает подложки. На внутренней границе протекают окислительно-восстановительные реакции типа:
Образующаяся элементарная примесь диффундирует в кремний.
Аналогично идет процесс и в случае применения В2О3:
n B2O3 + m SiO2 → В2n Sim03n +2m.
Дата добавления: 2021-02-19; просмотров: 845;











