Биотехнология получения метаболитов, с использованием генномодифицированных микроорганизмов
Важной составной частью биотехнологии является генетическая инженерия. Методы генной инженерии преобразуют клетки микроорганизмов в «фабрики» для масштабного производства любого белка. Это дает возможность детально анализировать структуру и функции белков и использовать их в качестве лекарственных средств.
Получение инсулина на основе методов генетической инженерии. Инсулин – гормон поджелудочной железы, регулирующий углеводный обмен и поддерживающий нормальный уровень сахара в крови. Недостаток этого гормона в организме приводит к сахарному диабету, который как причина смерти стоит на третьем месте после сердечнососудистых заболеваний и рака. Инсулин – небольшой глобулярный белок, содержащий 51 аминокислотный остаток и состоящий из двух полипептидных цепей, связанных между собой двумя дисульфидными мостиками. Синтезируется он в виде одноцепочечного предшественника – препроинсулина, содержащего концевой сигнальный пептид (23 аминокислотных остатка) и 35-звенный соединительный пептид (С-пептид).
Ранее инсулин получали из клеток поджелудочной железы животных, поэтому стоимость его была очень высока. Для получения 100 г кристаллического инсулина требуется 800 – 1000 кг поджелудочной железы, а одна железа коровы весит 200 – 250 грамм. Это делало инсулин дорогим и труднодоступным для широкого круга диабетиков.
В 1978 году исследователи из компании «Генентек» впервые получили инсулин в специально сконструированном штамме кишечной палочки. Клетки Е. coli, трансформированные рекомбинантными плазмидами (pBR322), содежащими синтетические гены инсулина, производили гибридные белки, состоящие из фрагмента β-галактозидазы и А или В пептида инсулина, присоединенного к ней через остаток метионина. При обработке химерного белка бромцианом пептид освобождался.
В 1980 г. была выделена мРНК инсулина из опухолевых клеток поджелудочной железы крысы и с помощью обратной транскриптазы получили с нее кДНК. Полученную кДНК встроили в плазмиду pBR322 E. coli, в среднюю часть гена пенициллиназы. Рекомбинантная плазмида содержала информацию о структуре проинсулина. В результате трансляции мРНК в клетках синтезировался гибридный белок, содержащий последовательности пенициллиназы и проинсулина, который выделяли из такого белка трипсином. Из 1000 литров культуральной жидкости можно получать до 200 граммов гормона, что эквивалентно количеству инсулина, выделяемого из 1600 кг поджелудочной железы свиньи или коровы.
Получение соматотропина на основе методов генетической инженерии. Соматотропин – гормон роста человека (ГРЧ), секретируемый гипофизом. Молекула ГРЧ состоит из 191 аминокислотного остатка. Недостаток этого гормона приводит к гипофизарной карликовости. Гормон обладает видовой специфичностью. Ранее его получали из трупного материала, из одного трупа: 4 – 6 мг соматотропина в пересчете на конечный фармацевтический препарат. Препарат из трупного материала представляет собой смесь белков, из которых пять имеют 22 кДа, другие являются димерами, а остальные – фрагментами, образующимися при протеолизе. Это приводило к тому, что у 30 % больных, получавших препарат, против гормона вырабатывались антитела, сводившие на нет его биологическую активность.
В настоящее время ГРЧ синтезируют методами генетической инженерии в специально сконструированных клетках бактерий. Ген гормона роста человека длиной 584 п.н. сначала клонируют; далее путем расщепления получают последовательность, кодирующую аминокислотный порядок гормона, за исключением первых 23 аминокислот, затем получают синтетический полинуклеотид, соответствующий аминокислотам от первой до двадцать третьей со стартовым ATG-кодоном в начале. После этого два фрагмента объединяют в единую структуру с помощью ДНК-лигазы и встраевают в плазмиду, реплицирующуюся в Е. coli под контролем промотора триптофанового оперона.
Трансформированные полученной химерной плазмидой клетки Е. coli продуцируют при индукции промотора около 3 млн. молекул гормона роста человека в расчете на клетку. Этот полипептид, как было установлено в экспериментах на крысах с удаленным гипофизом, по функциям оказался полностью идентичен гормону роста человека.
Получение интерферонов на основе методов генетической инженерии. Интерферон – ценный лекарственный препарат, широко используемый для борьбы с вирусными инфекциями и лечения рассеянного склероза, остеосаркомы, миеломы и некоторых видов лимфом. Интерферон вырабатывается в клетках животных и человека, но обладает выраженной видовой специфичностью. Клетки животных, подвергнутые воздействию вируса, выделяют в среду фактор, способный придавать клеткам устойчивость к вирусной инфекции, препятствуя (интерферируя) размножению вирусов в клетке.
Известны три группы интерферонов: α-интерфероны (α-И), образующиеся при воздействии вирусов на лейкоциты; β-интерфероны (β-И), появляющиеся при воздействии вирусов на фибробласты; γ-интерфероны, продуцируемые Т-лимфоцитами в ответ на воздействие бактериальными и вирусными антигенами или антисыворотками против поверхностных детерминант лимфоцитов.
Традиционно интерфероны извлекают из крови человека (из 1 л крови можно выделить всего 1 мкг интерферона, т. е. примерно одну дозу для инъекции). Получение β-интерферонов осуществляется с использованием лимфобластоидных клеток. С этой целью клетки фибробластов, получаемые из тканей плода и поддерживаемые в культуре клеток индуцируют вирусом сендай, после чего интерферон выделяют с помощью хроматографических колонок, заполненных моноклональными антителами против получаемого интерферона. В целом вышеперечисленные методы получения интерферонов характеризуются низким выходом, высокой стоимостью и недостаточной чистотой препарата.
На современном этапе наиболее перспективный метод – биосинтез интерферонов с помощью генетически сконструированных микроорганизмов (рис. 8.13).
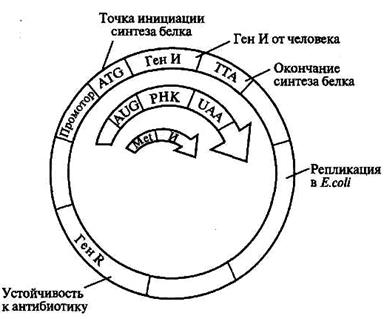 Рис. 8.13. Схема рекомбинантной плазмиды
Рис. 8.13. Схема рекомбинантной плазмиды
| кДНК, полученные обратным транскрибированием, клонируют в Е. coli (ген интерферона встраивают в векторную ДНК, и к нему присоединяют бактериальные регуляторные элементы, программирующие его транскрипцию и трансляцию в бактериальной клетке). |
Установлено, что интерфероны синтезируются в клетке сначала в виде предшественников, содержащих на N-конце полипептидной цепи сигнальный пептид, который затем отщепляется, и в результате образуется зрелый интерферон, обладающий полной биологической активностью. Бактерии не содержат ферментов способных отщепить сигнальный пептид с образованием зрелого белка. Поэтому для того чтобы бактерии синтезировали зрелый интерферон, следует ввести в плазмиду только ту часть гена, которая его кодирует, и удалить часть гена, кодирующую сигнальный пептид. Данная процедура осуществлется следующим образом. Ген интерферона содержит три участка расщепления рестриктазой Sau 3А1, из которых один находится рядом с сигнальной частью. Неполное расщепление гена этим ферментом позволяет выделить фрагмент гена, содержащий нуклеотидную последовательность, кодирующую зрелый интерферон, но без первого цистеина. Триплет ATG, кодирующий цистеин, отщепляют ферментом вместе с сигнальной частью. Для восстановления полинуклеотидной последовательности полного гена химически синтезируют небольшой фрагмент ДНК, содержащий данный триплет, а также примыкающий к нему триплет ATG – точка инициации синтеза белка. Этот фрагмент присоединяют к изолированной части зрелого гена, и в результате получают полный ген зрелого интерферона. Реконструированный ген вводят в плазмиду таким образом, что с ним оказался рядом участок ДНК-промотор, обеспечивающий начало синтеза мРНК.
Синтезированный генно-инженерным способом интерферон имеет близкие физико-химические свойства интерферону, полученного из крови доноров. Удалось получить бактерии, способные синтезировать до 5 мг интерферона на 1 л бактериальной суспензии, содержащей примерно 1011 бактериальных клеток, что в 5000 раз превосходит то количество интерферона, которое можно извлечь из 1 л крови доноров.
При использовании генно-инженерных технологий в разных лабораториях были получены штаммы бактерий, продуцирующих различные интерфероны: α-, β- и γ-типов. Недостаток использования Е. coli для получения β- и γ-интерферонов – отсутствие в бактерии аппарата гликозилирования эукариотических белков, что приводит к синтезу негликозилированных молекул. И хотя роль гликозилирования неясна и негликозилированные β- и γ-интерфероны практически полностью сохраняют противовирусную активность, эта особенность диктует осторожный подход к использованию генно-инженерных препаратов в медицинской практике.
В настоящее время гены интерферонов клонированы в дрожжи и клетки высших эукариот, способных осуществлять гликозилирование.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ:
1. Аминокислоты и их использование в пищевой промышленности и медицине
2. Химический и микробиологический синтез аминокислот.
3. Использование ауксотрофных мутантов для биосинтеза L-лизина.
4. Биотехнологическое получение лизина.
5. Биотехнологическое получение триптофана.
6. Ферментативный способ получения аминокислот.
7. Микробиологический синтез лимонной кислоты.
8. Микробиологический синтез витаминов группы В, витаминов А и Д.
9. Принципы классификации антибиотиков.
10. Стадии производства антибиотиков. Условия проведения ферментации, особенности выделения готового продукта
11. Микробиологическое производство пенициллина. Фермент пенициллаза. Синтез аналогов пенициллина.
12. Ферментативный способ получения 6-аминопенициллановой кислоты и её ацилированние.
13. Производство инсулина. Биосинтез и физиологическое действие.
14. Выделение инсулина из поджелудочной железы домашних животных.
15. Микроорганизмы с рекомбинантной ДНК, содержащей ген человеческого инсулина.
16. Производство интерферонов. Производство лейкоцитарного интерферона из донорской крови.
17. Ген интерферона и синтез копии ДНК интерферона на мРНК. Микроорганизмы с рекомбинантной ДНК с геном интерферона. Биотехнология производства интерферона, особенности его выделения и очистки.
18. Производство соматотропина. Выделение соматотропина из трупного материала.
19. Биотехнологический способ производства соматотропина.
Дата добавления: 2016-10-26; просмотров: 7891;











