Получение антибиотиков
Антибиотики – специфические продукты жизнедеятельности организмов или их модификации, обладающие высокой физиологической активностью по отношению к определенным группам микроорганизмов или к злокачественным опухолям, задерживая их рост или полностью подавляя их развитие. К антибиотикам относятся низкомолекулярные эффекторы изначально природного происхождения, способные подавлять рост живых клеток.
Антибиотики возникли в борьбе за существование почвенных биоценозов, поэтому многие из них служат средствами нападения и защиты, т.е. представляют собой своеобразное химическое «оружие» клетки. Однако эти функции у антибиотиков не единственны. Известно, что они могут участвовать в процессах детоксикации вредных метаболитов, контролировать некоторые стороны обмена веществ и целые процессы развития, например, дифференцировку клеток, служить запасными питательными веществами. В процессе образования антибиотиков задействовано значительное число генов. Массовая расшифровка первичной структуры геномов микроорганизмов показала, что эта величина равна 1 – 2 %. Так, у Bacillus subtilis число таких генов достигает 2 %, что обеспечивает микроорганизму большие возможности для защиты и адаптации. С другой стороны, это обстоятельство затрудняет анализ путей биосинтеза антибиотиков и идентификацию отдельных мутаций, способных увеличить выход продукта.
Способность нитчатого гриба зеленой плесени Penicillium notatum вызывать гибель микроорганизмов впервые была установлена в 1928 г. английским микробиологом А. Флеммингом. Однако лечебные свойства этой плесени были описаны еще в 1871 г. русским дерматологом А. Г. Полотебновым. Открытие антибиотиков произвело переворот в лечении инфекционных заболеваний. Ушли в прошлое представления о неизлечимости многих бактериальных инфекций (туберкулез, сепсис, сифилис и др.). Антибиотики применяют в ряде отраслей народного хозяйства (растениеводство, животноводство, ветеринария, пищевая промышленность и др.), где они используются более широко, чем в медицине, например, для лечения сельскохозяйственных животных, борьбы с фитопатогенными микроорганизмами, а также для увеличения биомассы животных (биомицин – производное тетрациклина). Антибиотики широко используют в качестве молекулярных инструментов при исследовании фундаментальных проблем биологии, таких, как расшифровка механизмов биосинтеза белка, нуклеиновых кислот и структуры клеточных стенок бактерий, создание моделей транспорта ионов через биологические мембраны и др.
Количество открываемых антибиотиков постоянно растет. В 1940 г. было известно всего 6 антибиотиков, а в настоящее время описано более 12 000 аналогичных соединений, из которых в клинике применяют около 200 препаратов. 97 % известных антибиотиков токсичны, поэтому в практике не используются.
Изыскание новых форм антибиотиков обусловлено как потребностями практики, так и накоплением резистентных форм микроорганизмов по отношению ко многим антибиотикам. Устойчивость бактерий к пенициллинам и цефалоспоринам создает присутствующий в их клетках энзим лактамаза (пенициллиназа). Фермент гидролизует амидную связь β-лактамного цикла в молекуле антибиотика с образованием пенициллиновой кислоты, которая полностью лишена антимикробной активности:
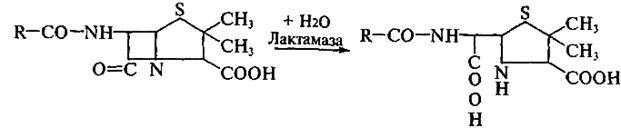
Пенициллин Пенициллиновая кислота
Резистентность микроорганизмов к антибиотикам обеспечивается разнообразием фенотипов резистентности и разнообразием и стабильностью систем горизонтального генного транспорта. Поэтому главное направление получения новых антибиотиков состоит не в открытии новых соединений, а в химической трансформации природных молекул для создания полусинтетических антибиотиков, характеризующихся значительно меньшей резистентностью и токсичностью, но более широким спектром действия, большим временем жизни, химической и биологической устойчивостью. Важный подход на пути получения устойчивых аналогов антибиотиков – использование природных ингибиторов β-лактамаз – клавулановой и оливановой кислот.
Классификация антибиотиков. По типу действия антибиотики делят на бактерицидные (лактамные, аминогликозиды), вызывающие гибель микроорганизмов, и бактериостатические (макролиды, тетрациклины, левомицетин), нарушающие способность микроорганизмов делиться.
По спектру действия различают антибиотики узкого и широкого действия. К последним относят тетрациклины, макролиды, аминогликозиды, которые особенно полезны в случае неидентифицированных возбудителей болезни, однако при длительном применении они вызывают у пациентов дисбактериоз.
Особенность молекулярного механизма действия антибиотиков – исключительная специфичность их действия. Специфика действия их состоит в избирательном подавлении этими эффекторами одного или нескольких процессов у некоторых микроорганизмов. Таким образом, антибиотики блокируют метаболические мишени в клетках-мишенях.
В зависимости от специфики действия антибиотиков на молекулярном уровне различают следующие группы соединений:
1. антибиотики, ингибирующие синтез клеточной стенки (пенициллины, ванкомицин, цефалоспорины, D-циклосерин);
2. антибиотики, нарушающие функции мембран (альбомицин, аскозин, грамицидины, кандицидины, нистатин, трихомицин, эндомицин и др.);
3. антибиотики, избирательно подавляющие синтез (обмен) нуклеиновых кислот:
а) РНК (актиномицин, гризеофульвин, канамицин, неомнцин, новобиоцин, оливомицин и др.);
б) ДНК (актидион, митомицины, новобиоцин, саркомицин и др.);
4. антибиотики – ингибиторы синтеза пуринов и пиримидинов (азасерин, саркомицин и др.);
5.антибиотики, подавляющие синтез белка (канамицин, метимицин, неомицин, тетрациклины, хлорамфеникол, эритромицин и др.);
6. антибиотики – ингибиторы дыхания (олигомицины, пиоцианин, усниновая кислота и др.);
7. антибиотики – ингибиторы окислительного фосфорилирования (валиномицин, грамицидины, колицины, олигомицин, тироцидин и др.);
8. антибиотики, обладающие антиметаболитными свойствами, т.е. выступают в качестве антиметаболитов аминокислот, витаминов, нуклеиновых кислот (фураномицин – антиметаболит лейцина);
9. антибиотики-иммуномодуляторы (актиномицины С и D, оливомицин, рубомицин).
В зависимости от химической природы и ряда других свойств известные антибиотики делят на следующие классы:
· β-Лактамные составляют более 50 % рынка антибиотиков и относятся к азотсодержащим гетероциклическим соединениям. В эту группу входит большое число антибиотиков, молекулы которых содержат разнообразные, часто очень сложные кольчатые системы (рис 8.4). Характерная особенность строения β-Лактамных антибиотиков – наличие в молекуле β-лактамного кольца (пенициллины, цефалоспорины):
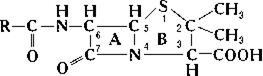
| Рис.8.4.Структура пенициллина. Ядро молекулы – 6-аминопенициллановая кислота (6-АПК) – гетероциклическое соединение, состоящее из 4-членного β-лактамного (А) и 5-членного тиазолидинового (В) колец. |
· Тетрациклины входят в группугетероциклических соединений(рис.8.5.) и обладают широким спектром действия (тетрациклин, морфоциклин, метациклин).
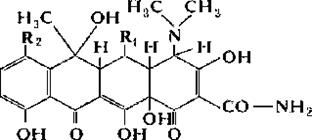
Рис.8.5.Структура тетрациклинов. Тетрациклин: R1 = H; R2 = H; Хлортетрациклин: R1 = H; R2 = Cl;Окситетрациклин: R1 = OH; R2 = H.
· Макролиды. Характерная особенность антибиотиков этой группы –
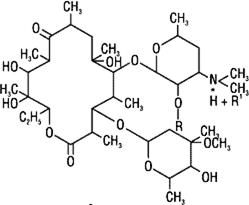 Рис.8.6. Структура эритромицина
Рис.8.6. Структура эритромицина
| присутствие в молекуле макроциклическою лактонного кольца, связанного с одним или несколькими углеводными остатками (рис. 8.6). К антибнотнкам-макролидам относятся метимицин, эритромицин, магнамицин, олеандомицин и др. |
· Аминогликозиды – группа антибиотиков, общим в химическом строении которых является наличие в молекуле аминосахара, соединённого гликозидной связью с аминоциклическим кольцом (рис 8.7).
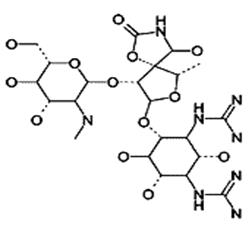 Рис.8.7. Структура стрептомицина А
Рис.8.7. Структура стрептомицина А
| Основное клиническое значение аминогликозидов заключается в их активности в отношении аэробных грамотрицательных бактерий К ним принадлежат стрептомицины, канамицины неомицины, гентамицин, тобрамицин, нетилмицин, сизомицин, амикацин. |
· Антибиотики-полипептиды.Среди изученных в химическом отношении антибиотиков этой группы наиболее распространены циклопептиды, состоящие из остатков L- и D-аминокислот. К ним относятся антибиотики, образуемые бактериями (тироцидины, грамицидины, бацитрацины, полимиксины, низины, бацилломицины и др.) и актиномицетами (этамицин, эхиномицины и др.)
· Амфениколы. Соединения, относящиеся к этой группе, являются производными бензола (рис.8.8). К ним относятся галловая кислота, хлорамфеникол, левомицетин и др.
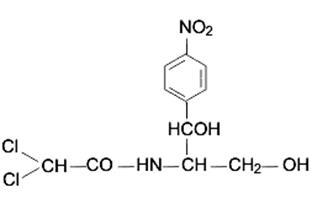
|
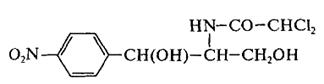
|
| Рис.8.8. Структура хлорамфеникола и левомицетина |
· Антибиотики-олигомицины.К. этой группе относятся соединения,
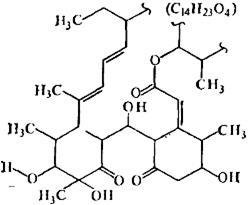 Рис.8.9. Частичная структура олигомицинов
Рис.8.9. Частичная структура олигомицинов
| содержащие в молекуле сопряженную диеновую систему. По химическому строению эти соединения относятся к макролактонам (рис.8.9). В качестве примера можно назвать олигомицины А, В и С, ботримицин и др. |
· Полиеновые антибиотики, характерная особенность которых – наличие системы, содержащей от трех до восьми сопряженных двойных связей, —(СН=СН)— (рис.8.10). Многие антибиотики этой группы содержат аминосахар (микозамин, перозамин), отдельные вещества в структуре имеют вторую азотсодержащую часть – ароматические кетоны. К числу полиеновых антибиотиков относится большое число (более 150) веществ (микротриен, ареномицин, нистатин, фумагиллин, леворин).
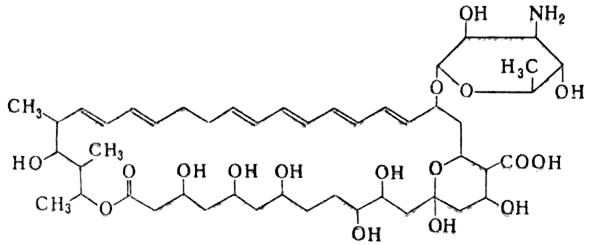
Рис.8.10. Структура нистатина
· Антибиотики-хиноны.В группу входят бензохиноны (рапанон, фумигатин и др.), нафтохиноны (плюмбагин, яваницин и др.) и антрахиноны (эндокроцин и др.).К группе антибиотиков-хинонов относятся антрациклины, насчитывающие около 70 наименований. Многие из этих антибиотиков, образуемых стрептомицетами, обладают протиобактериальной активностью, а часть из них и противоопухолевым действием. К последним относятся дауномицин, адриамицин (доксорубицин) и кармипомнцик (рис. 8.11).
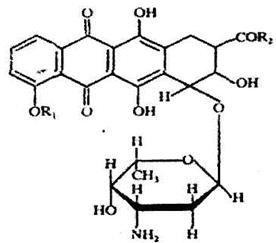
|
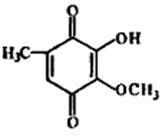
|
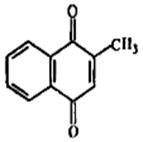
|
| а | б | в |
| Рис.8.11. Структура хинонных антибиотиков: а) дауномицин; б) фумигатин; в) плюмбагин |
· Антибиотики-депсипептиды.Характерная особенность этих антибиотиков (валиномицин, амидомицин и др.) состоит в том, что они построены из остатков α-окси- и α-аминокислот, соединенных между собой сложноэфирными и амидными связями (рис 8.12).
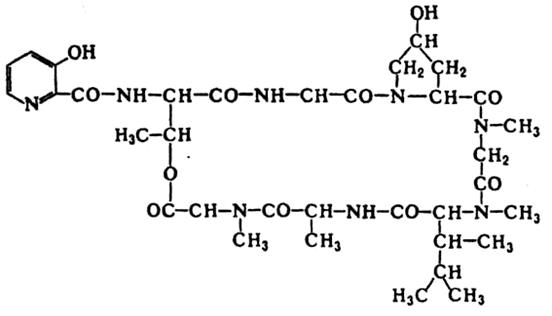
Рис.8.12. Структура амидомицина
В зависимости от биологического происхождения антибиотики подразделяют на:
· антибиотики, вырабатываемые микроорганизмами, относящимися к эубактериям:пиоцианин – Pseudomonas aeruginosa, вискозин – Ps. viscose, дипломицин, низин – Lactococcus lactis, продигиозин – Serratia marcescens, колиформин – Escherichia coli, протаптины – Proteus vulgaris, грамицидины – Bacillus brevis, субтилин – В. subtilis, полимиксины – В. polymyxa;
· антибиотики, образуемые микроорганизмами, принадлежащими к порядку Actinomycetales:
а) образуемые представителями рода Streptomyces:стрептомицин – S. griseus,тетрациклины – S. aureofaciens, Str. rimosus, новобиоцин – S. spheroides, эритромицин – Saccharopolyspora erythraea,актиномицины – S. antibioticus и др.;
б) образуемые представителями рода Nocardia: рифамицины – N. mediterranei, ристомицин – N.fructiferi и др.;
в) образуемые родом Actinomadura:карминомицин – A. carminata и др.;
г) продуцируемые родом Micromonospora: фортимицины – М. olivoasterospora,гентамицины – М. риrриrеа;
· антибиотики, образуемые цианобактериями: малинголид – Lyngbya majuscula;
· антибиотики, образуемые несовершенными грибами: пенициллин – Penicillium chrysogenum, гризеофульвин – P. griseofulvum, трихотецин – Trichotecium roseum;
· антибиотики, образуемые грибами, относящимися к классам базидиомицетов и аскомицетов: термофиллин – базидиомицет Lenzites thermophila, лензитин – Lenzites sepiaria, хетомин – Chaetomium cochloides (аскомицет);
· антибиотики, образуемые лишайниками, водорослями и низшими растениями: усниновая кислота (бинан) – лишайником Usneaflorida, хлореллин – водорослью Chlorella vulgaris;
· антибиотики, образуемые высшими растениями: аллицин – Allium sativum, рафанин – Raphanus sativum, сативин – чеснок, томатин – томаты, алин – лук, фитоалексины: пизатин в горохе (Pisum sativus), фазеолин в фасоли (Phaseolus vulgaris);
· антибиотики животного происхождения: лизоцим, экмолин, круцин, интерферон.
Методы получение антибиотиков. Методы получения антибиотиков путем химического синтеза чрезвычайно сложны и не могут конкурировать с их биосинтезом методами биотехнологии.
Существует несколько способов получения как природных, так и полусинтетических антибиотиков:
· Направленный биосинтез антибиотиков осуществляемый путем прямой ферментации микроорганизма продуцента с подходящим предшественником, что индуцирует синтез ферментов вторичного метаболизма в идиофазе. Например, производство бензилпенициллина в значительной степени стимулируется добавками его метаболического предшественника – фенилуксусной кислоты; пропионовая кислота и пропиловый спирт инициируют биосинтез макролидов через метилмалонилКоА; L-фенилаланин – ускоряет образование грамицидина S.
· Использование ингибиторов метаболизма. Так, при подавлении процесса введения хлора микроорганизм S. аureofaciens образует тетрациклин, а не хлортетрациклин, при ингибировании реакции метилирования им синтезируется деметилированное производное хлортетрациклина.
· Использование для биосинтеза антибиотиков блокированных мутантов, у которых отсутствует (блокировано) определенное звено в цепи реакций, ведущих к синтезу антибиотика. Блокированные мутанты не способны образовывать нужный антибиотик. Используя низкую субстратную специфичность ферментов вторичного метаболизма и вводя аналоги предшественников антибиотика, последние переводят в аналоги самого антибиотика в ходе процесса, известного как мутационный биосинтез, или мутасинтез:
а) предполагаемая последовательность реакций, ведущая к синтезу антибиотика: А→Bфермент →C→D→E→антибиотик
б)отсутствие синтеза антибиотика у «блокированного мутанта»:


 А→В фермент → C→D
А→В фермент → C→D
в) синтез модифицированного антибиотика после введения аналога предшественника (D*): D*→ E*→модифицированный антибиотик
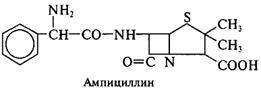
Принципы производства полусинтетических пенициллинов. Получение новых более эффективных аналогов пенициллина основано на изменении природы его ацильной группировки при сохранении в неизменном виде ядра пенициллина – 6-аминопенициллановой кислоты (6-АПК). В промышленности 6-АПК получают путем гидролиза природных пенициллинов с помощью специфического фермента ряда штаммов микроорганизмов – пенициллинацилазы. Ацилазы различают по их субстратной специфичности. Некоторые из ацилаз способны катализировать и обратные реакции – процессы ацилирования аминогруппы 6-АПК с образованием модифицированного пенициллина. Во многих случаях 6-АПК не выделяют из культуральной жидкости, например при превращении бензилпенициллина в ампициллин:
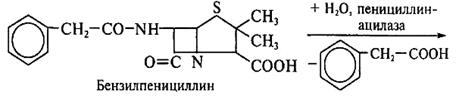
| 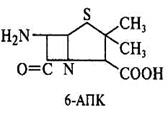
|

 Бензилпенициллин гидролизуют ацилазой мутанта Kluyvera citrophila при рН 7,8 – 8,0 и температуре 40 – 50 °С. Затем в ферментатор вносят мутант Pseudomonas melanogenum и фенилглицин. Условия ферментации изменяют таким образом (рН 5,0 – 5,5), чтобы ацилаза второго мутантного организма осуществляла синтез ампициллина:
Бензилпенициллин гидролизуют ацилазой мутанта Kluyvera citrophila при рН 7,8 – 8,0 и температуре 40 – 50 °С. Затем в ферментатор вносят мутант Pseudomonas melanogenum и фенилглицин. Условия ферментации изменяют таким образом (рН 5,0 – 5,5), чтобы ацилаза второго мутантного организма осуществляла синтез ампициллина:
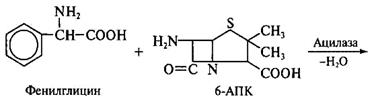
| 
|
Замена ацильного остатка приводит к синтезу других полусинтетических антибиотиков
Технология промышленного получения антибиотиков. Биосинтез антибиотиков, как и любых других вторичных метаболитов, возрастает в фазе замедленного роста клеточной популяции (конец трофофазы) и достигает максимума в стационарной фазе (идиофазе). В конце трофофазы изменяется энзиматический статус клеток, появляются индукторы вторичного метаболизма, освобождающие гены вторичного метаболизма из-под влияния катаболитной репрессии. Поэтому любые механизмы, тормозящие клеточную пролиферацию и активный рост, стрессовые ситуации, активируют процесс образования антибиотиков.
Процесс культивирования идиолитов проходит две фазы (двустепенчатое культивирование). На первой фазе происходит накопление достаточного количества биомассы, которая выращивается на среде для роста микроорганизма. Эта фаза должна быть быстрой, а питательная среда дешевой. На второй фазе осуществляются запуск и активный синтез антибиотика. На этой фазе ферментацию ведут на продуктивной среде.
Образование антибиотиков регулируется условиями культивирования микроорганизмов. Поэтому оптимизация питательной среды является главным фактором в повышении выхода продукта.
Многие антибиотики берут свое начало от промежуточных соединений обмена первичных метаболитов, поэтому их биосинтез регулируется путем ретроингибирования. Так, биосинтез пенициллина культурой гриба Penicillium chrysogenum контролируется по принципу обратной связи L-лизином. Кроме ретроингибирования биосинтез многих антибиотиков тормозится высокими концентрациями своих же антибиотиков. Следует отметить, что в процессе эволюции микроорганизмы выработали механизмы защиты от действия собственных антибиотиков. Эта проблема успешно решается в результате использования иммобилизованных ферментов.
Большинство антибиотиков получают при глубинной аэробной ферментации периодического действия в асептических условиях. Период ферментации длится 7 – 10 суток. Технология завершающих стадий процесса определяется природой антибиотика, характером производства и целями дальнейшего использования антибиотиков.
Для медицинских целей технология выделения и очистки имеет особое значение. Обычно она включает сложные многоступенчатые комбинации различных операций: экстракцию антибиотиков подходящими растворителями, осаждение и перекристаллизацию их из разных сред, фракционирование на ионообменных смолах, лиофильную и распылительную сушку готовых препаратов. Антибиотики выделяют или в виде сравнительно неочищенных препаратов (натриевая соль пенициллина), или в виде высокоочищенных веществ (прокаиновая соль пенициллина), предназначенных для клинического использования. Выход антибиотиков обычно составляет несколько десятков граммов на 1 л.
Все антибиотики проходят биологический и фармакологический контроль. Биологический контроль позволяет определить стерильность готового препарата. Для этого используют метод внесения инактивированного антибиотика в стерильную питательную среду. Фармакологический контроль включает в себя определение спектра действия, токсичности (острой и хронической), устанавливают максимально переносимую дозу (МПД), дозу, вызывающую 50 % гибели животных (LD 50) и дозу смертельную для всех животных (LD 100). После всестороннего изучения препарата может быть рекомендован к практическому применению.
Дата добавления: 2016-10-26; просмотров: 11530;











