Производство аминокислот
Среди соединений, получаемых биотехнологическими методами, аминокислоты занимают первое место по объему производства и второе место по стоимости, уступая по последнему параметру антибиотикам. Объем мирового производства аминокислот составляет более 500 тыс. т в год. Однако указанный объем – лишь небольшая доля от требуемого количества аминокислот. По данным ВОЗ, потребность человечества всего лишь в четырех незаменимых аминокислотах составляет, млн т: для лизина – 5, метионина – 4, треонина – 3,7 и триптофана – 2.
В промышленных масштабах белковые аминокислоты получают:
· гидролизом природного белоксодержащего сырья;
· химическим синтезом;
· микробиологическим синтезом;
· биотрансформацией предшественников аминокислот с помощью микроорганизмов или выделенных из них ферментов (химико-микробиологический метод).
Гидролиз природного белоксодержащего сырья. При гидролизе белоксодержащее сырье (отходы пищевой и молочной промышленности) нагревают с растворами кислот или щелочей при температуре 100 – 105 °С в течение 20 – 48 ч. Чаще всего используют 20 %-й раствор соляной кислоты, обеспечивающий глубокий гидролиз белка. В ходе кислотного гидролиза белков происходят рацемизация и разрушение некоторых составляющих их аминокислот. При кислотном гидролизе полностью разрушается триптофан и достаточно значительны потери цистеина, метионина и тирозина (10 – 30 %). Кроме того, для ускорения реакции гидролиза белков используют иммобилизованные протеолитические ферменты и ионообменные смолы. Аминокислоты, полученные методом гидролиза, используют, в медицине, животноводстве, пищевой и микробиологической промышленности.
Химический синтез.Используя метод химического синтеза аминокислот целевой продукт получают в виде рацемической смеси D- и L-стереоизомерных форм. Подавляющее большинство природных аминокислот относится к L-ряду. D-α-аминокислоты обнаружены лишь в составе гликопротеинов клеточных стенок бактерий, антибиотиков и некоторых токсинов. Проницаемость L-аминокислот в клетке в 500 раз превышает таковую ее антипода. Стереоспецифичны также транспорт и метаболизм аминокислот. Разделение рацематов других аминокислот – дорогая и чрезвычайно трудоемкая процедура.
Исключением в этом отношении является лишь метионин, метаболизм которого нестереоизбирателен, благодаря чему данная аминокислота получается преимущественно путем химического синтеза, что экономически более выгодно в сравнении с микробиологическим способом.
Микробиологический синтез. Наиболее перспективен и экономически выгоден микробиологический синтез аминокислот. Более 60 % всех производимых в настоящее время промышленностью высокоочищенных препаратов белковых аминокислот получают именно этим способом, главное преимущество которого в сравнении с методами химического синтеза состоит в возможности получения L-аминокислот на основе возобновляемого сырья.
Большинство диких штаммов микроорганизмов способны продуцировать аминокислоты во внешнюю среду в очень незначительных количествах. Среди возможных продуцентов глутаминовой кислоты отмечены организмы, из которых 30 % – дрожжи, 30 % – стрептомицеты, 20 % – бактерии и 10 % – микроскопические грибы.
Перспективные штаммы продуцентов постоянно улучшают посредством селекции мутантов с измененной генетической программой и регуляторными свойствами. Распространенные объекты селекции продуцентов – микроорганизмы, относящиеся к родам Brevibacterium, Micrococcus, Corynebacterium, Arthrobacter (табл. 8.1).
Таблица 8.1.
Микроорганизмы – продуценты аминокислот
| Аминокислота | Микроорганизмы |
| Аргинин | Е. coli, Bacillus subtilis, Corynebacterium glutamicum, Brevibacterium flavum, Serratia marcescens |
| Гистидин | B.flavum, С glutamicum, S.marcescens, виды Steptomyces |
| Изолейцин | В. flavum, С. glutamicum, В. subtilis, S. marcescens |
| Лейцин | Brevibacterium lactofermentum, S. marcescens, C. glutamicum |
| Лизин | В. flavum, С. glutamicum |
| Фенилаланин | В. flavum, С. glutamicum |
| Пролин | В. flavum |
| Серин | С. glutamicum |
| Треонин | B.flavum, С. glutamicum, E. coli, Arthrobacte rparafinens, S. marcescens |
| Триптофан | Micrococcus, Candida utilis, B. subtilis |
| Тирозин | В. flavum, С. glutamicum |
| Валин | В. flavum, С. glutamicum |
Разработка технологической схемы получения отдельной аминокислоты базируется на знании путей и механизмов регуляции биосинтеза конкретной аминокислоты. Необходимого дисбаланса метаболизма, обеспечивающего сверхсинтез целевого продукта, добиваются путем строго контролируемых изменений состава и условий среды.
Производство лизина.Метаболический путь и характеристика продуцентов.В клетках микроорганизмов лизин синтезируется из аспарагиновой кислоты и служит конечным продуктом разветвленного метаболического пути биосинтеза, общего для трех аминокислот – лизина, метионина и треонина (рис.8.2). В процессе образования аминокислот из общего предшественника одновременно с лизином возникают две другие аминокислоты – метионин и треонин. В этом случае эффекта накопления в среде всего одной целевой аминокислоты добиваются путем блокирования процессов, ведущих к синтезу побочных аминокислот, возникающих в связи с разветвлением метаболического пути.
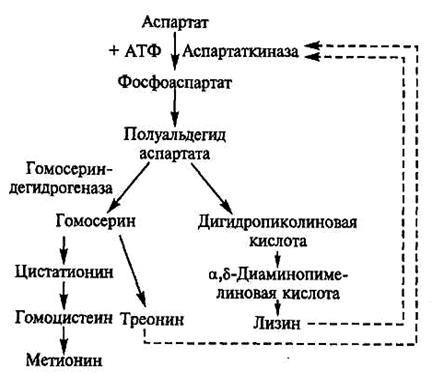
| Фермент аспартаткиназа, открывающий метаболический путь, является аллостерическим белком, чувствительным к ингибированию по принципу обратной связи при совместном и согласованном действии побочных продуктов L-треонина и L- лизина. |
| Рис.8.2. Схема биосинтеза лизина, метионина и треонина в клетках Corynebacterium glutamicum и Brevibacterium flavum |
При накоплении треонина и лизина в избыточной концентрации инги-бируется аспартаткиназа и их синтез останавливается, при пониженной концентрации любой из двух аминокислот процесс активизируется.
Чтобы добиться о бразования лизина в больших количествах, получают мутанты двух типов. У мутантов первого типа не синтезируется или не функционирует гомосериндегидрогеназа, в результате чего блокируется синтез метионина и треонина. Такие мутанты являются ауксотрофами по гомосерину или треонину (метионину); внутриклеточная концентрация треонина у них существенно снижена, что снимает блокаду с аспартаткиназы.
Мутанты второго типа дефектны по структурному гену, детерминирующему конформацию аспартаткиназы. В итоге фермент теряет чувствительность к концентрациям аллостерического ингибитора – лизина.
Технология получения. В качестве источников углерода для культивирования продуцентов лизина используют вторичное сырье: свекловичную мелассу, молочную сыворотку, гидролизаты крахмала, сульфитные щелока. Источниками азота являются мочевина и соли аммония. Кроме того, в питательную среду добавляют необходимые для жизнедеятельности макро- и микроэлементы (Р, Са, Mg, Mn, Fe и др.); стимуляторы роста, в качестве которых выступают экстракты кукурузы, дрожжей и солодовых ростков, гидролизаты отрубей и дрожжей, витамины группы В. Степень аэрации индивидуальна для производства каждого конкретной продуцента.
Лизин появляется в культуральной среде начиная с середины экспоненциальной фазы роста культуры и достигает максимума к ее концу. Поэтому на первой стадии технологического процесса формируют биомассу продуцента, которую выращивают в специальных посевных аппаратах в течение суток (рН 7,0 – 7,2; температура 28 – 30 °С), а затем подают в производственный ферментер, заполненный питательной средой. Лизин начинает поступать в культуральную жидкость через 25 – 30 ч после начала ферментации. Важный фактор, обеспечивающий в культуральной среде высокие концентрации аминокислоты, синтезированной внутри клетки, – проницаемость клеточных мембран. Проницаемость клеточной мембраны увеличивают либо с помощью мутаций, либо путем изменения состава питательной среды. В последнем случае в культуральной среде создают дефицит биотина (1 – 5 мкл/л), добавляют пенициллин (2 – 4 мкг/л), детергенты (твин-40 и твин-60) или производные высших жирных кислот (пальмитаты, стеараты). Биотин контролирует содержание в клеточной мембране фосфолипидов, а пенициллин нарушает биосинтез клеточных стенок бактерий, что повышает выделение аминокислот в среду.
По завершении процесса ферментации (через 55 – 72 ч) жидкую фазу отделяют от культуры клеток микроорганизма фильтрованием и используют для выделения из нее лизина.
Высокоочищенные препараты лизина получают после фракционирования фильтрата культуральной жидкости методом ионообменной хроматографии на катионите. С этой целью лизин переводят в форму катиона:
 H3N—СН—СООН
H3N—СН—СООН
 (СН2)4
(СН2)4
NH3
Для данного процесса фильтрат обрабатывают соляной кислотой до рН 1,6 – 2,0. Обладая двумя положительно заряженными ионогенными группировками, лизин прочно сорбируется на смоле и элюируется с нее в виде индивидуального соединения 0,5 – 5 %-м раствором гидроксида аммония после выхода всех других катионов. Элюат концентрируют в вакууме при температуре 60 оС, переводят в форму монохлоргидрата, после чего высушивают и дополнительно чистят с помощью перекристаллизации. В результате получают препараты кристаллического лизина 97 – 98 %-й чистоты, которые используют для повышения питательной ценности пищевых продуктов и в медицинской промышленности.
Кроме высокоочищенных препаратов лизина получают иные виды его товарной формы: жидкий концентрат лизина (ЖКЛ), сухой кормовой концентрат лизина (ККЛ) и высококонцентрированные кормовые препараты, характеризующиеся относительно меньшей степенью очистки в сравнении с первым препаратом.
Производство триптофана. Метаболический путь и характеристика продуцентов. Подобно лизину триптофан образуется в ходе разветвленного метаболического пути (рис.8.3).
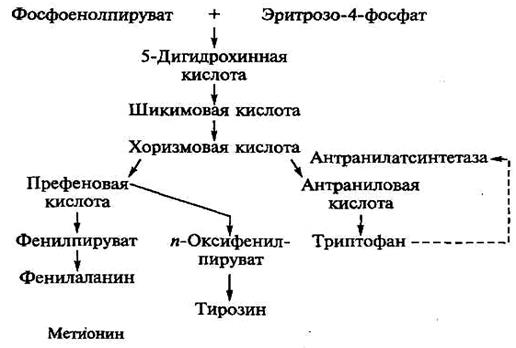
Рис.8.3. Метаболический путь синтеза триптофана
Однако при использовании ауксотрофных мутантов, у которых блокированы реакции, ведущие к синтезу фенилаланина и тирозина в среде, избыточное накопление триптофана в среде не наблюдается, что объясняется особенностью регуляции биосинтеза триптофана у микроорганизмов. Метаболическим предшественником триптофана служит антраниловая кислота, которая возникает из хоризмовой кислоты под действием антранилатсинтетазы. Триптофан оказывает ингибирующее действие на антранилатсинтетазу, поэтому для обхода метаболического контроля синтез фермента индуцируют ступенчатым введением предшественника – антраниловой кислоты.
В связи с этой особенностью промышленное производство триптофана организовано преимущественно по двухступенчатой схеме.
Технология получения. На первом этапе химическим способом синтезируют антраниловую кислоту, которую с помощью энзиматической системы мутантных штаммов дрожжей Candida utilis переводят в триптофан.
Биомассу дрожжей выращивают при температуре 30 °С в среде, содержащей свекловичную мелассу, мочевину и минеральные компоненты. Через сутки в ферментер вводят 5 %-й спиртовой раствор антраниловой кислоты и 50 %-й раствор мочевины, а через 3 – 4 ч после введения предшественника дополнительно добавляют источник углерода (25 %-й раствор мелассы). Антраниловую кислоту и мочевину подают через каждые 6 ч, а мелассу – через каждые 12 ч. Процесс двухступенчатой ферментации завершается через 144 ч и обеспечивает содержание триптофана в культуральной среде до 6 г/л.
После сушки культуральной жидкости получают кормовой концентрат триптофана (ККТ), который включает белки, свободный триптофан, витамины В1 В2 и PP. Высокоочищенные кристаллические препараты триптофана образуются после дополнительной очистки культуральной жидкости методом ионообменной хроматографии на колонке, заполненной катионитом (сорбция при рН 1,0; элюция 5%-м раствором гидроксида аммония в смеси с пропанолом-2). Элюаты кристаллизуют; кристаллы отмывают и высушивают. Кристаллический препарат содержит до 99 % триптофана.
Кроме триптофана микробиологическим способом с использованием предшественников получают гистидин, изолейцин, метионин, серии и треонин.
Химико-микробиологический метод. В последние годы при производстве аминокислот все шире используют биотрансформацию предшественников аминокислот, с помощью иммобилизованных ферментов или клеток микроорганизмов, предварительно получаемых химическим путем.
Применение ферментов в производстве аминокислот обеспечивает стереоспецифичность процессов их синтеза, что выгодно отличает биотехнологические производства от химических.
Получение L-лизина.Процесс получения лизина основан на стереоспецифическом ферментативном гидролизе (конверсии) D-,L-α-амино-ε-капролактама, который сначала получают химическим путем из циклогексена: 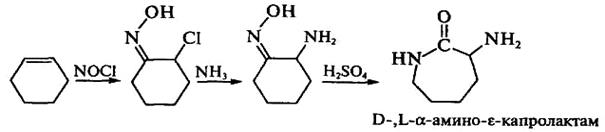
Рацемат используют в качестве субстрата, который под действием фермента L- α-амино-ε-капролактамгидролазы (лактамаза) превращается в L-лизин, а оставшаяся непрореагировавшая его часть (D-форма) переводится при воздействии рацемазы в смесь антиподов:
Лактамаза найдена у некоторых видов дрожжей и бактерий, в частности у Candida laurentii. При производстве лизина в водный раствор D-,L-α-амино-ε-капролактама одновременно вводят источники лактамазы и рацемазы, содержащиеся в дрожжевых и бактериальных клетках. Процесс осуществляется при температуре 30 – 50 °С, рН 8,0 – 8,5 и оптимальном режиме аэрации. На выходе из реактора образуется преимущественно один продукт – лизин, который выделяют из смеси, очищают и сушат. Описанная технология получения лизина обеспечивает содержание аминокислоты в реакционной среде свыше 150 г/л. Кроме того, созданы мутанты, у которых целевой продукт – лизин далее не вовлекается в обмен веществ, что увеличивает выход искомого продукта.
Получение триптофана. Химико-ферментативный способ получения триптофана состоит в прямой конденсации индола, аммиака и пировиноградной кислоты:
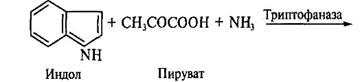
| 
|
Реакцию катализирует пиридоксальзависимая триптофаназа. Фермент найден у бактерий Е. coli, Bacillus albei, Proteus rettgeri и характеризуется широкой субстратной специфичностью. Добавление триптофана индуцирует образование фермента, а добавление индола ингибирует его синтез у бактерий, поэтому процесс получения триптофана ведут при избытке аммиака и пирувата. Выход аминокислоты при реализации химико-энзиматического способа получения триптофана составляет 63 г/л.
Перечень целевых аминокислот, производимых химико-ферментативным способом разнообразен (L-аспарагиновая кислота, L-аланин, L-глутамин, L-лизин, L-тирозин, L-триптофан, L-цистеин, L-фенилаланин, L-метионин). Химико-энзиматический способ в сравнении с микробиологическим более специфичен, не требует процедуры очистки аминокислот от побочных продуктов и сточных потоков. Однако по стоимости сырья и ферментативных препаратов он еще уступает микробиологическому способу.
Применение аминокислот. Помимо применения в качестве пищевых добавок, приправ и усилителей вкуса аминокислоты используют как сырье в химической, парфюмерной и фармацевтической промышленности и при производстве ряда других веществ:
| цистеин | фармацевтический препара |
| гистидин | противовоспалительное средство |
| глицин | подсластитель, антиоксидант, бактериостатик |
| глутаминовая кислота | усилитель вкуса, препарат для лечения психических заболеваний |
| аспарагиновая кислота | усилитель вкуса, сырье для синтеза аспартама |
| фенилаланин | сырье для получения аспартама |
| лизин | пищевая и кормовая добавки, сырье для получения искусственных волокон и пленок |
| метионин | пищевая и кормовая добавки |
| треонин и триптофан | пищевые и кормовые добавки |
Дата добавления: 2016-10-26; просмотров: 16806;











