Вопрос 1. Сахароза. Её строение, свойства, получение и применение.
Ответ.Опытным путём доказано, что молекулярная форма сахарозы
– C12H22O11. Молекула содержит гидроксильные группы и состоит из взаимно связанных остатков молекул глюкозы и фруктозы.
Физические свойства
Чистая сахарозы – бесцветное кристаллическое вещество сладкого вкуса, хорошо растворимое в воде.
Химические свойства:
1. Подвергается гидролизу:
C12H22O11 + H2O 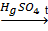 C6H12O6 + C6H12 O6
C6H12O6 + C6H12 O6
2.Сахароза – невосстанавливающий сахар. Она не даёт реакции «серебряного зеркала», а с гидроксидом меди ( II) взаимодействует как многоатомный спирт, не восстанавливая Cu (II) до Cu (I).
Нахождение в природе
Сахарозы входит в состав сока сахарной свеклы ( 16-20 %) и сахарного тростника ( 14-26%). В небольших количествах она содержится вместе с глюкозой в плодах и листьях многих зелёных растений.
Получение:
1. Сахарную свекл или сахарный тростник превращают в тонкую стружку и помещают в диффузоры, через которые пропускают горячую воду.
2. Полученный раствор обрабатывают известковым молоком, образуется растворимый сахарат кальция алкоголятов.
3. Для разложения сахарата кальция и нейтрализации избытка гидроксида кальция через раствор пропускают оксид углерода ( IV):
C12 H 22 O11• CaO•2H2 + CO2 = C12 H22 O11 + CaCO3 + 2H2O
4.Полученный после осаждения карбоната кальция раствор фильтруют затем упаривают в вакуумных аппаратах и кристаллики сахара отделяют центрифугированием.
5. Выделенный сахарный песок обычно имеет желтоватый цвет, так как содержит красящие вещества. Для их отделения сахарозу растворяют в воде и пропускают через активированный уголь.
Применение:
Сахароза в основном используется в качестве продукта питания и в кондитерской отрасли промышленности. Путём гидролиза из неё получают искусственный мёд.
Вопрос 2. Особенности размещения электронов в атомах элементов малых и больших периодов. Состояния электронов в атомах.
Ответ.Атом – химически неделимая, электронейтральная частица вещества. Атом состоит из ядра и движущихся по определённым орбиталям вокруг него электронов. Атомная орбиталь – область пространства вокруг ядра, в пределах которой наиболее вероятно нахождение электрона. Орбитали называют также электронными облаками. Каждой орбитали отвечает определённая энергия а также форма и размер электронного облака. Группа орбиталей, для которых значение энергии оказываются близкими, относят к одному энергетическому уровню. На энергетическом уровне не может находится более 2n2электронов, где n – номер уровня.
Виды электронных облаков: шаровой формы - s-электроны, одна орбиталь на каждом энергетическом уровне; гантелеобразной формы – p-электроны, три орбитали px, py,pz; в форме напоминающей две перекрещенные гантеи, - d- электроны, пять орбиталей d xy, dxz, dyz, d2z , d2x – d2y.
Распределение электронов по энергетическим уровням отражает электронная конфигурация элемента.
Правила заполнения электронами энергетических уровней и
подуровней.
1.Заполнение каждого уровня начинается с s- электронов, далее происходит заполнение электронами p-, d- и f- энергетических уровней.
2.Число электронов в атоме равно его порядковому номеру.
3. Число энергетических уровней соответствует номеру периода, в котором находится элемент.
4. максимальное число электронов на энергетическом уровне определяется по формуле
N = 2n2
Где n- номер уровня.
5. Общее число электронов на атомных орбиталях одного энергетического уровня.
Например, алюминий, заряд ядра равен +13
Распределение электронов по энергетическим уровням – 2,8,3.
Электронная конфигурация
13Al:1s22s22p63s23p1.
В атомах некоторых элементов наблюдается явление проскока электронов.
Например, у хрома электроны с 4s-подуровня перескакивают на 3d- подуровень:
24Cr 1s22s22p63s23d53d54s1.
Электрон переходит с 4s- подуровня на 3d, потому что конфигурация 3d5 и 3d10 являются более энергетически выгодными. Электрон занимает положение, в котором его энергия минимальная.
Заполнение электронами энергетического f-подуровня происходит у элемента 57La -71 Lu.
Вопрос 3. Распознать вещества KOH,HNO3,K2 CO3.
Ответ: KOH + фенолфталиен → малиновая окраска раствора;
NHO3 + лакмус → красная окраска раствора,
K2CO3 + H2SO4 = K2SO4 + H20 +CO2↑
Билет № 20
Вопрос 1. Генетическая связь органических соединений различных классов.
Ответ:Схема цепочки химических превращений:
C2H2 → C2H4→C2H6→C2H5Cl→C2H5OH→CH3CHO→CH3COOH
↓ ↓ ↓ ↓
C6H6 C2H5OH CH2=CH-CH=CH2 CH3COOC2H5
↓ ↓ ↓
C6H5Cl CH3O-C2H5 C4H10
↓
C6H5Cl
↓
C6H5OH
↓
C6H2Br3OH
Реакции :
C2H2 + H2 = C2H4,
алкин алкен
C2H4 + H2 = C2H6,
алкен алкан
C2H6 + Cl2 = C2H5Cl + HCl,
C2H5Cl + NaOH = C2H5OH + NaCl,
хлоралкан спирт
С2H5OH + 1/2O2 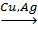 CH3CHO + H2O,
CH3CHO + H2O,
спирт альдегид
CH3CHO + 2Cu(OH)2 = CH3COOH + 2CuOH + H2O,
кислота
C2H4 + H2O 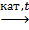 C2H5OH,
C2H5OH,
алкен спирт
C2H5OH + CH3OH = CH3O-C2H5 + H2O,
спирт спирт простой эфир
3С2H2 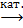 С6Н6,
С6Н6,
алкин арен
C6H6 + Cl2 = C6H5Cl + HCl,
C6H5Cl + NaOH = C6H5OH + NaCl,
фенол
C6H5OH + 3Br2 = C6H2Br3OH + 3HBr;
2С2H5OH = CH2 = CH-CH = CH2 + 2H2O + H2,
спирт диен
CH2 = CH-CH = CH2 + 2H2 = C4H10.
диен алкан
Алканы- углеводороды с общей формулой СnH2n+2, которые не присоединяют водород и другие элементы.
Алкены- углеводороды с общей формулой СnH2n , в молекулах которых между атомами углерода имеется одна двойная связь.
К диеновым углеводородам относят органические соединения с общей формулой СnH2n-2, в молекулах которых имеются две двойные связи.
Углеводороды с общей формулой СnH2n-2, в молекулах которых имеется одна тройная связь, относят к ряду ацетилена и называют алкинами.
Соединения углерода с водородом, в молекулах которых имеется бензольное кольцо, относят к ароматическим углеводородам.
Спиртами называются производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами.
К фенолам относят производные ароматических углеводородов, в молекулах которых гидроксильные группы связаны с бензольным ядром.
Альдегиды- органические вещества, содержащие функциональную группу- СНО ( альдегидную группу).
Карбоновые кислоты- это органические вещества, молекулы которых содержат одну или несколько карбоксильных групп, соединенных с углеводородным радикалом или атомом водорода.
К сложным эфирам относятся органические вещества, которые образуются в реакциях кислот со спиртами и содержат группу атомов С(О)-О-С.
Вопрос 2. Типы кристаллических решеток. Характеристика веществ с различными типами кристаллических решеток.
Ответ.Кристаллическая решетка – пространственное, упорядоченное взаиморасположением частиц вещества, имеющее однозначный, распознаваемый мотив.
В зависимости от вида частиц, расположенных в узлах решетки, различают : ионные (ИКР), атомные (АКР), молекулярные (МКР), металлические (Мет. КР), кристаллические решетки.
МКР – в узлах находится молекула. Примеры : лед, сероводород, аммиак, кислород, азот в твердом состоянии. Силы, действующие между молекулами, сравнительно слабые, поэтому вещества имеют малую твердость, низкие температуры кипения и плавления, плохую растворимость в воде. В обычных условиях это газы или жидкости (азот, пероксид водорода, твердый CO2). Вещества с МКР относятся к диэлектрикам.
АКР- в узлах атомы. Примеры : бор, углерод (алмаз), кремний, германий. Атомы соединены прочными ковалентными связями, поэтому для веществ характерны высокие температуры кипения и плавления, высокая прочность и твердость. Большинство таких веществ не растворимо в воде.
ИКР – в узлах катионы и анионы. Примеры : NaCl, KF, LiBr. Такой тип решетки имеется у соединений с ионным типом связи (металл-неметалл). Вещества тугоплавкие, малолетучие, сравнительно прочные, хорошие проводники электрического тока, хорошо растворимы в воде.
Мет. КР – решетка веществ, состоящих только из атомов металла. Примеры : Na, K, Al, Zn, Pb и т.д. Агрегатное состояние твердое, нерастворимо в воде. Кроме щелочных и щелочно-земельных металлов, проводники электрического тока, температуры кипения и плавления колеблются от средних до очень высоких.
Вопрос 3. Задача. Для сжигания 70 г серы взяли 30 л кислорода. Определить объем и количество вещества, образовавшегося сернистого газа.
Дано : Найти :
m(S) = 70 г, V(SO2) = ?
V(O2) = 30 л. v(SO2) = ?
Решение :
m=70г V=30 л x л
S + O2 = SO2.
v : 1 моль 1 моль 1 моль
M : 32 г/моль -- --
m : 32 г -- --
V : -- 22,4 л 22, 4 л
V(O2)теор. = 70 * 22,4/32 =49 л (O2 в недостатке, расчет по нему).
Поскольку V(SO2) = V(O2), то V(SO2) = 30 л.
v(SO2) = 30/22,4 = 1,34 моль.
Ответ. V(SO2) = 30 л, v = 1,34 моль.
Дата добавления: 2016-07-18; просмотров: 8364;











