Встраивание ДНК в вектор
Молекулы ДНК, способные акцептировать чужеродную ДНК и автономно реплицироваться, называют векторными молекулами. К числу векторов относят плазмиды, бактериофаги, вирусы животных. Векторы должны обладать следующими особенностями:
· иметь субстратные участки для определенных эндонуклеаз рестрикции;
· иметь свойства репликона;
· содержать один или несколько маркерных генов, которые после проникновения вектора в клетку придают ей фенотип, свидетельствующий о присутствии вектора. В частности, для бактериальных векторов в качестве маркерных генов чаще всего используются гены, вызывающие устойчивость клеток к некоторым антибиотикам.
Таким образом, все векторы обеспечивают репликацию встроенных генов, их экспрессию, интеграцию в хромосому клетки и т. д.
Типы векторов для введения гена в клетку
Плазмиды– бактериальные репликоны (внехромосомные элементы наследственности), стабильно наследуемые. Они представляют собой двуцепочечные кольцевые молекулы ДНК с вариабельными молекулярными массами. По размеру они соответствуют 1 – 3 % генома бактериальной клетки.
Плазмиды разделяют на конъюгативные, способные сами перенестись в реципиентные клетки с помощью конъюгации, и неконъюгативные, не обладающие этим свойством. Они детерминируют разные свойства: резистентность к антибиотикам (R-плазмиды); биодеградацию (D-плазмиды) и др. Например, плазмиды стафилококков несут гены устойчивости к пенициллину, соединениям ртути и др. Гены устойчивости к тяжелым металлам обнаружены также в составе R-плазмид Е. coli. Плазмиды могут управлять синтезом инсектицида в клетках Bacillus thuringiensis. F-плазмида Е. coli или FP-плазмиды псевдомонад являются половыми факторами. У различных микроорганизмов – Е. coli, Salmonella, Bacillus, Saccharomyces обнаружены Col-плазмиды, обеспечивающие синтез разных колицинов – высокоспецифических антибиотиков, подавляющих жизнедеятельность других штаммов микроорганизмов того же вида или родственных видов. Поскольку плазмидная ДНК значительно меньше хромосомной, ее довольно легко выделить в чистом виде. В присутствии ионов кальция плазмиды легко поглощаются бактериями-рецепиентами, даже если те их никогда не содержали, и в клетках бактериального потомства можно обнаружить много копий поглощенной плазмиды. Однако бактериальная клетка обычно может содержать в своем составе плазмиды одного типа. Это явление несовместимости плазмид. Существуют группы несовместимости – Inc-группы (от английского incompatibility – несовместимость). В такой группе может быть несколько плазмид, совместимых между собой, но не совместимых с другими плазмидами. У этих плазмид сходны многие признаки и часто значительна гомология ДНК.
Число копий плазмиды в клетке может существенно варьировать. Это зависит от генетических особенностей как клетки, так и плазмиды. Плазмиды, находящиеся «под ослабленным контролем», могут размножаться до тех пор, пока их количество не достигнет 10 – 200 копий на клетку. Если же плазмида находится «под строгим контролем», она реплицируется с той же скоростью, что и главная хромосома. Такие плазмиды содержатся в клетке в одной или в нескольких копиях. Для клонирования рекомбинантных ДНК стараются использовать плазмиды первого типа.
Одна их наиболее часто употребляемых плазмид для клонирования pBR 322 создана на основе плазмид природного происхождения, выделенных из E. Coli (рис.3.7).
Эта плазмида содержит гены устойчивости к двум антибиотикам: ампициллину и тетрациклину, причем в генах устойчивости к этим антибиотикам имеются сайты рестрикции. Если фрагмент чужеродной ДНК встраивается в один из генов устойчивости, то последний инактивируется. Следовательно, успешное встраивание фрагмента чужеродной ДНК в один из этих генов легко детектировать по исчезновению у бактерий устойчивости к данному антибиотику. Но при этом сохраняется устойчивость к другому антибиотику. Таким образом вектор дает возможность детектировать только те клоны бактерий, которые содержат рекомбинантную плазмиду.
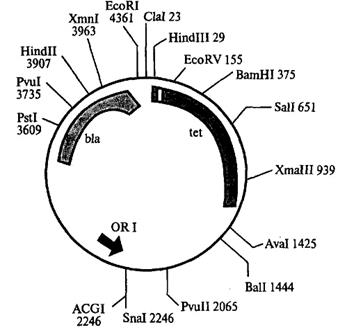
| Рис.3.7. Плазмида pBR 322 Ген tet - устойчивости к тетрациклину, содержит участки расщепления рестриктазами HindIIIl, BamHI и SaiI Ген bla – устойчивости к ампициллину, содержит участок расщепления PstI |
Вирусы являются одними из главных кандидатов на роль векторов для введения чужеродной ДНК. При вирусной инфекции каждая клетка может получить большое число копий чужеродного гена. ДНК можно встраивать так, чтобы она находилась под контролем сильных вирусных промоторов, что обеспечит высокий уровень экспрессии гена, и его продукты будут более доступны для исследования.
В последние годы сконструированы многочисленные «челночные» векторы и их рекомбинантные производные, способные к репликации в животной и бактериальной клетке и эффективно экспрессирующие клонируемый ген в животной клетке. Наиболее распространенные векторы состоят из плазмиды рВR322 и интактного онкогенного ДНК вируса SV40.
Вирус должен быть жизнеспособным после рекомбинирования его ДНК. Легче всего вирусы вводятся в бактерии. Недостатком вирусов как векторов является их небольшая емкость. Кроме того, вирусы заражают небольшой круг хозяев.
Существуют гибридные вектора, содержащие ДНК фага и плазмиды. К ним относятся, например, космиды и фазмиды.
Космиды – плазмидные вектора, в которые встроен участок генома фага λ, обеспечивающий возможность упаковки этой молекулы ДНК в фаговую частицу. Фаговые частицы обеспечивают хорошее проникновение гибридной ДНК в клетку (путем инъекции), после чего происходит замыкание ДНК в кольцо по липким концам и репликация ее по плазмидному типу.
Фазмиды также являются гибридами между фагом и плазмидой. После встройки чужеродной ДНК могут в одних условиях развиваться как фаги, в других – как плазмиды.
Вироиды –это необычные патогены – самые простые и самые маленькие из всех известных. Из всех известных в настоящее время инфекционных агентов имеют ранг наиболее странных. В 1971 году были открыты инфекционные агенты, представляют собой очень короткую цепь 1 нитевой ковалентно связанной кольцевой РНК, состоящую из 270-300 нуклеотидов (на три порядка меньше самых минимальных вирусов), не заключенную в белковую оболочку. Каким образом вироиды продуцируют симптомы болезни в инфицированных растениях, не известно до сих пор. Установлено, что они реплицируются ферментами клетки-хозяина, не транслируются в видоспецифичные полипептиды, интегрируются в геном клетки-хозяина.
Вироиды заражают персиситентно, т.е. мигрируют из сайта внедрения в другие части растений, переносятся механически или через клеточный сок, через семена, пыльцу.
При работе с вироидами получают 1-нитевую ДНК- копию РНК и достраивают комплементарную нить для получения 2-нитевой ДНК вироида. Такая 2-цепочечная ДНК вcтраивается в плазмиду и передается в клетки E. coli для клонирования. Однонитевые и двунитевые ДНК способны инициировать репликацию вироида в механически инокулированных растениях табака. Вироиды инфицируют своих хозяев в течение всего их жизненного цикла, поэтому в случае использования вироидных векторных систем можно ожидать постоянной экспрессии чужеродного гена в растении.
Хлоропластная и митохондриальная ДНК также могут выступать в качестве возможных векторов для переноса генов в клетку. Структурная организация этих клеточных субгеномов существенно различается.
Хлоропласты и другие пластиды обладают одинаковой генетической информацией, так называемым пластомом. У высших растений он представляет собой замкнутую молекулу ДНК длиной 150 т. н. п., достаточную для кодирования примерно 100 белков. Различные типы пластид содержат неодинаковые количества идентичных копий пластома: от 10 – 20 копий в пластидах корней и зрелых хлоропластах до сотен копий в молодых хлоропластах картофеля. Такой уровень амплификации позволяет надеяться на надежную экспрессию чужеродной ДНК при использовании их в качестве векторов в генноинженерных экспериментах. Гены растений также способны к экспрессии в клетках Е. coli. Преимущество хлоропластных генов заключается в том, что их экспрессия к клетках кишечной палочки может быть достигнута путем простого объединения транскрибируемых последовательностей, т.к. в ДНК хлоропластов и бактерий до начала стартовых кодонов трансляции расположена одинаковая нуклеотидная последовательность. Это дает возможность синтезировать растительные экономически важные полипептиды с помощью клеток прокариот.
ДНК митохондрий характеризуются исключительным разнообразием и их величина колеблется от 200 до 2400 т. н. п.. Однако никакой корреляции между размером митохондриального генома и числом белковых продуктов, синтезируемых изолированными митохондриями, не наблюдается. В составе митохондриальной ДНК имеются структурные гены, кодирующие полипептиды, гены рибосомных и транспортных РНК.
Гены митохондрий кодируют 2 группы признаков – работу дыхательных систем и устойчивость к антибиотикам и другим ядам. В митохондриальном геноме растений есть также гены, отвечающие за признак мужской стерильности цитоплазмы.
Транспозоны – сегменты ДНК, которые контролируют собственную транспозицию (перемещение) из одного сайта ДНК в другой путем вырезания из исходного сайта и внедрения в новый сайт хромосомы или плазмиды.
Как правило, мобильные генетические элементы многократно повторены в геноме и образуют гетерогенные семейства, члены которых диспергированы по хромосомам. Поведение транспозонов можно расценить как паразитическое. Длина их от 2 до 10 тысяч нуклеотидных пар. У высших эукариот на долю транспозонов приходится примерно 10 % ДНК клетки. Большинство их перемещается изредка, но, так как их в клетке довольно много, транспозиция оказывает значительное влияние на разнообразие видов.
Биологический смысл перемещения отдельных сегментов ДНК заключается в прерывании соответствующего гена, что ведет к эволюции, а также в регуляции деятельности генов, так как транспозоны могут нести сигналы для начала считывания генов. Транспозоны также участвуют в горизонтальном переносе генов.
Поскольку подвижные гены могут перемещаться в пределах генома с одного места на другое, то они могут быть весьма эффективными векторами для передачи рекомбинантной ДНК. Перенос генов при помощи транспозонов имеет большие преимущества, так как он происходит с высокой частотой и не влечет значительных перестроек интегрируемой ДНК. Кроме того, этим методом можно переносить достаточно большие фрагменты ДНК.
Дата добавления: 2016-10-26; просмотров: 4212;











