Методы генной инженерии
Секвенирование ДНК.В настоящее время определение точной нуклеотидной последовательности любого сегмента ДНК умеренной длины – вполне разрешимая задача. Уже определена последовательность нескольких сотен генов про- и эукариот. Зная последовательность гена и генетический код, легко определить аминокислотную последовательность кодируемого им белка. Раньше для определения структуры белка приходилось делать тщательный и весьма трудоемкий анализ выделенного и очищенного белка. Если секвенирование белка занимает месяцы и даже годы, то ДНК удается секвенировать за несколько недель.
В биотехнологии рекомбинантных ДНК обычно используют два различных метода секвенирования ДНК: химический и ферментативный (метод Сангера).
Химический метод секвенирования ДНК. Исходный фрагмент ДНК, меченный 32Р по 5'-концу, подвергается специфическому расщеплению по определенному нуклеотиду (например, А), в результате чего образуются радиоактивные и нерадиоактивные фрагменты разной длины.
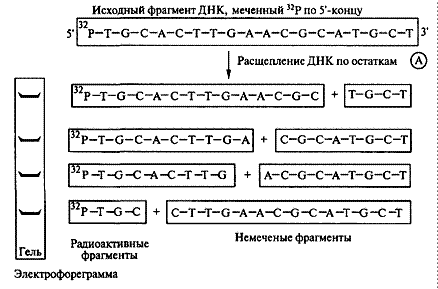 Рис. 3.1. Химический метод секвенирования ДНК
Рис. 3.1. Химический метод секвенирования ДНК
| Например, если А будет находиться в положении 1, 4, 7, 20 во фрагменте из 221 основания, то будут получены радиоактивные фрагменты длиной 4, 7, 20 оснований, а также свободный аденин |
Обычно химическая процедура расщепления ДНК выпол няется одновременно для четырех одинаковых проб ДНК с использованием химических агентов, расщепляющих ДНК по отдельным нуклеотидам (Т, С, G и А).
В результате получается набор меченых фрагментов, длины которых определяются расстоянием от разрушенного основания до конца молекулы. Фрагменты, образовавшиеся во всех четырех реакциях, подвергают электрофорезу в четырех соседних дорожках; затем проводят радиоавтографию, и те фрагменты, которые содержат радиоактивную метку, оставляют "отпечатки" на рентгеновской пленке. По положению отпечатков можно определить, на каком расстоянии от меченого конца находилось разрушенное основание, а зная это основание – его положение. Так набор полос на рентгеновской пленке определяет нуклеотидную последовательность ДНК. Аналогично наблюдают флюоресцентное окрашивание. Если для каждого из четырех нуклеотидов был подобран свой цвет флюоресцентной метки, то при электрофорезе их наносят на 1 дорожку. Тогда расположение нуклеотидов отмечено штрихами разного цвета, а процедуру считывания легко автоматизировать.
Энзиматический метод секвенирования(метод Сингера) основан на энзиматическом введении нуклеотида, терминирующего полинуклеотидную цепь.
Перед собственно секвенированием проводят амплификацию ДНК участка, последовательность которого требуется определить. Амплификация (умножение) требуемого фрагмента молекулы ДНК происходит в результате многократного воспроизведения стандартного цикла полимеразной цепной реакции (ПЦР), который включает три последовательные стадии:
· разделение цепей ДНК;
· связывание праймеров с цепями ДНК;
· полимеразный синтез новых цепей ДНК с образованием копий нужного фрагмента ДНК.
Это позволяет увеличить количество ДНК в образце и, таким образом, определить последовательность большей длины(рис. 3.2).
Образец ДНК нагревают до температуры, при которой происходит расхождение цепей. Затем в реакционную смесь добавляют дезоксинуклеозидтрифосфаты (dNTP) и праймер – короткий олигонуклеотид, комплементарный небольшому сегменту ДНК-матрицы. Он гибридизуется с этим сегментом, и ДНК-полимераза последовательно присоединяет к его концу dNTP, комплементарные нуклеотидам копируемой цепи. Процесс многократно повторяют, пока не получат миллионы копий каждого фрагмента
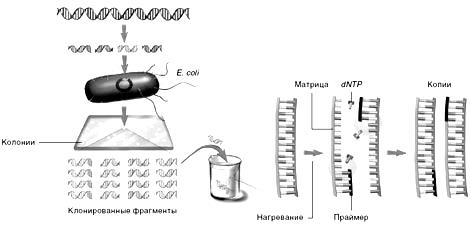
Рис 3.2. Полимеразная цепная реакция
Метод Cэнгера основан на использовании ДНК-полимеразы I. В клетке этот фермент участвует в процессе репликации, заполняя пробелы между вновь синтезированными фрагментами ДНК (фрагментами Оказаки). Для работы фермента в пробирке требуются:
· предшественники ДНК – дезоксирибонуклеотидтрифосфаты (dNTP);
· одноцепочечная матрица, на которой должен быть небольшой двухцепочечный участок – затравка, с которого начинается синтез;
· модифицированные дидезоксирибонуклеотиды, в которых дезоксирибоза 3’-ОН отсутствует, для каждого из четырех оснований ДНК (ddNTP).
ДНК-полимераза включает эти предшественники в ДНК. Однако, включившись в ДНК, модифицированное основание не может образовать фосфодиэфирную связь со следующим дезоксирибонуклеотидом. В результате рост (элонгация) данной цепи останавливается (терминируется) в том месте, где в ДНК включился дидезоксирибонуклеотид (ddNTP). Поэтому их называют терминаторами элонгации. (рис. 3.3.)
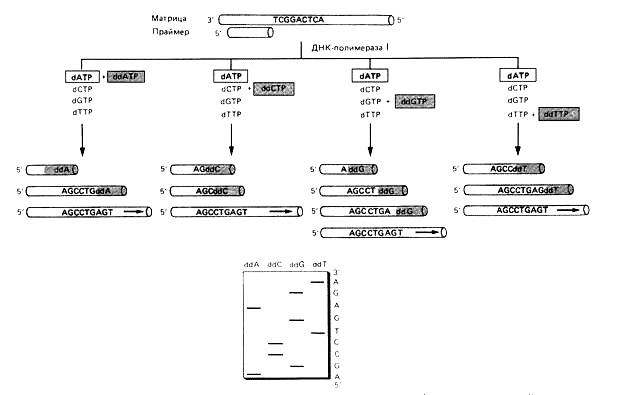
Рис. 3.3. Ферментативный метод секвенирования ДНК
Реакционная смесь по Сэнгеру состоит из цепи ДНК, нуклеотидную последовательность которой надо определить, короткого фрагмента "меченой" ДНК, комплементарной концевому отрезку этой цепи (затравка), одного из четырех ddNTP и соответствующего dNTP в строго определенном соотношении (чтобы они конкурировали), а также остальных трех dNTP. Готовят четыре смеси, каждая из которых содержит один из четырех ddNTP. В каждой из пробирок образуется набор меченых фрагментов разной длины. Длина их зависит от того, в каком месте в цепь включен дефектный нуклеотид.
Полученные меченые фрагменты ДНК разделяют в полиакриламидном геле (с точностью до одного нуклеотида), проводят радиоавтографию и по картине распределения фрагментов в четырех пробах устанавливают нуклеотидную последовательность ДНК.
Определение последовательности ДНК привело также к тому, что были обнаружены области, которые не кодируют белки, но принимают участие в регуляции экспрессии генов и репликации ДНК. В 1996 году был секвенирован геном дрожжей, в 1998 г. – геном арабидопсиса, в 2000 году – геном человека, однако в данном случае речь идет только об установлении последовательности нуклеотидов, так как генетическая структура и функции отдельных участков генома еще не идентифицированы, это более сложная задача.
Рестрикция (специфическое расщепление ДНК). Расщепление ДНК в специфических участках нуклеотидных последовательностей осуществляется особыми ферментами – рестрикцирующими нуклеазами бактерий, способными разрушить чужеродную ДНК (рис. 3.4).
Согласно номенклатуре, предложенной X. Смитом и Д. Натансоном, название рестриктазы складывается из трех букв: первая обозначает родовое название, две последующие – первые буквы вида. Например, фермент из Е. coli обозначают как Есо или из Haemophilus influenzae – Hinи т.д. Типовая или штаммовая идентификация следует за родовидовой, например, EcoRI или HindII и т.д
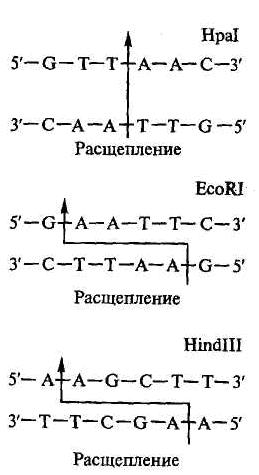 Рис.3.4. Действие рестриктаз
Рис.3.4. Действие рестриктаз
| Каждый фермент, способный разрушить чужеродную ДНК, опознает в ней специфическую последовательность из 4 – 6 нуклеотидов. Большинство ферментов разрывает только двунитевую ДНК с образованием серии фрагментов, называемых рестрикционными (или рестриктами с «тупыми» либо «липкими» концами. Многие рестриктазы вносят разрывы в две цепи ДНК со смещением на несколько нуклеотидов и образованием на концах фрагментов коротких одноцепочечных участков. Такие участки способны образовывать комплементарные пары оснований |
с любым другим одноцепочечным участком, полученным с помощью того же фермента (липкие концы). Липкие концы позволяют легко соединить два любых фрагмента ДНК в одно целое.
Полученный фрагмент ДНК (любого происхождения) можно встроить в очищенную ДНК плазмиды или бактериофага.
Лигирование фрагментов ДНК. Сшивка по одноименным "липким" концам (рестриктазно лигазный метод). Этот метод является самым распространенным и популярным. Впервые этим способом гибридная ДНК была получена С. Коэном с сотрудниками в 1973 году. Комплементарные друг другу участки ДНК имеют тенденцию к ассоциации за счет спаривания оснований, и поэтому их называют комплементарными или липкими концами. Спаривание оснований происходит только между комплементарными последовательностями, поэтому ААТТ-концы, образуемые Eco RI, не будут спариваться, например, с АГЦТ-концами, образуемыми Hind III. Но любые два фрагмента (независимо от их происхождения), образовавшиеся под действием одной и той же рестриктазы, могут слипаться за счет образования водородных связей между однонитевыми участками комплементарных нуклеотидов (рис. 3.5).
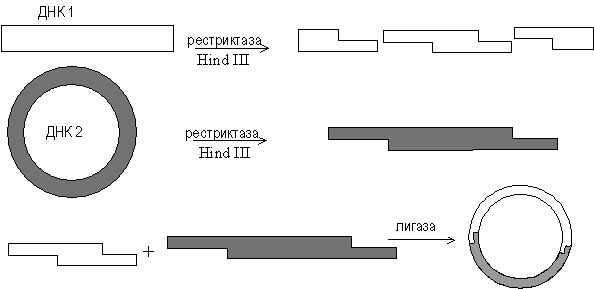
Рис. 3.5. Схема рестриктазно - лигазного метода
Однако после такого спаривания полной целостности двойной спирали не восстановится, поскольку останется два разрыва в фосфодиэфирном остове. Для его восстановления, то есть сшивания, или лигирования нитей используют фермент ДНК-лигазу. Этот фермент в живой клетке выполняет ту же функцию – сшивание фрагментов ДНК, синтезирующихся при репликации.
Сшивка по "тупым" концам (коннекторный метод). Липкие концы не абсолютно необходимы для связывания фрагментов ДНК. Тупые концы также могут быть соединены за счет действия ДНК-лигазы, если и лигаза, и тупые концы присутствуют в реакционной смеси в высоких концентрациях. В этом случае реакция лигирования имеет свои особенности и ее эффективность ниже, чем при сшивке по липким концам. Впервые такие эксперименты были выполнены в 1972 году Полем Бергом в Стенфордском университете, США. Липкие концы также можно ферментативным путем присоединить к молекулам ДНК с тупыми концами. Для этого используют фермент – концевую трансферазу из тимуса теленка, которая присоединяет нуклеотиды к 3 -концам цепей ДНК. Если к 3'-концам одного из рекомбинируемых in vitro фрагментов ДНК с помощью концевой дезоксинуклеотидилтрансферазы достроить одноцепочечные олиго (dA)-сегменты определенной длины, а к концам другого фрагмента — олиго (dT)-сегменты примерно такой же длины, то при смешении полученных таким образом фрагментов происходит спаривание за счет образования водородных связей между олиго (dА)- и олигo (dT) -последовательностями (рис. 3.6). Для ковалентного соединения двух фрагментов используется ДНК-лигаза. Эти процедуры составляют основу для второго общего метода получения рекомбинантных молекул ДНК.
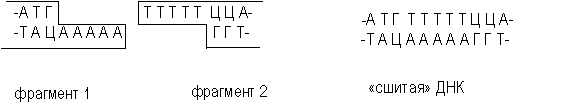
Рис. 3.6. Пришивание «липких» концов и сшивка фрагментов ДНК
Поскольку можно формировать достаточно длинные взаимокомплементарные одноцепочечные концы, гибридные молекулы образуются с высокой эффективностью.
Сшивка фрагментов с разноименными липкими концами. В ситуации, когда необходимо сшить фрагменты, образованные разными эндонуклеазами рестрикции, и имеющие разные, то есть некомплементарные друг другу липкие концы, применяют так называемые линкеры (или "переходники"). Линкеры – это химически синтезированные олигонуклеотиды, представляющие собой сайты рестрикции или их комбинацию. Впервые эту идею предложил Шеллер с сотрудниками в 1977 году.
Существуют большие наборы таких генных «переходников». При использовании линкеров должна учитываться необходимость соблюдения правил экспрессии генетической информации. Часто в середину линкера помещают какой-либо регуляторный генетический элемент, например, промотор или участок, связанный с рибосомой. В этом случае линкеры обеспечивают не только объединение генов, но и обуславливают их экспрессию. Существуют линкеры «тупой конец – липкий конец».
При необходимости липкие концы можно превратить в тупые. Это достигается либо отщеплением липких концов с помощью фермента – эндонуклеазы S1, которая разрушает только одноцепочечную ДНК, либо липкие концы "застраивают", то есть с помощью ДНК-полимеразы I на однонитевых липких концах синтезируют вторую нить.
Гибридизация нуклеиновых кислот. Если водный раствор ДНК нагреть до 100 оС и повысить рН до 13, то ДНК диссоциирует на 2 цепи (денатурирует), так как комплементарные связи между основаниями разрушаются. В 1961 году было обнаружено, что этот процесс обратим: выдерживание ДНК при температуре 65оС вело к восстановлению структуры двойной спирали. Этот процесс называется ренатурация или гибридизация. Процессы гибридизации происходят между любыми одинарными цепями, если они комплементарны: ДНК - ДНК, РНК - РНК, ДНК - РНК.
Скорость восстановления (ренатурации) двойной спирали зависит от вероятности столкновения двух комплементарных нуклеотидных последовательностей и их концентрации в растворе. Скорость реакции гибридизации можно использовать для определения концентрации любых последовательностей РНК или ДНК в смеси, содержащей и другие фрагменты нуклеиновых кислот. Для этого используют одноцепочечный фрагмент ДНК (или РНК), комплементарный к тому фрагменту, который надлежит выявить. Обычно фрагмент ДНК, полученный клонированием либо химическим путем, метят по 32Р в целях прослеживания включения фрагмента в состав дуплексов при гибридизации. Одноцепочечную молекулу ДНК, используемую в данном методе в качестве меченого индикатора, называют ДНК-зондом. Она может содержать от 15 до 1000 нуклеотидов. ДНК-зонды применяются в различных целях.
Реакция гибридизации с использованием ДНК-зондов позволяет идентифицировать нуклеотидные последовательности в очень низкой концентрации и тем самым определять, какое количество копий последовательности ДНК, комплементарной ДНК-зонду, присутствует в геноме клетки.
ДНК-зонды применяют для поиска родственных генов; в реакциях гибридизации с РНК – для выявления экспрессии данного гена в различных клетках.
Синтез нуклеотидных последовательностей дает возможность перестраивать гены. Обмен генами, а также введение в клетку гена другого вида организма осуществляют посредством генетической рекомбинации in vitro. Он основан на важном свойстве ДНК – способности к перестройкам, изменяющим комбинацию генов в геноме и их экспрессию. Такая уникальная способность ДНК позволяет приспосабливаться данному виду к изменяющейся среде.
Дата добавления: 2016-10-26; просмотров: 4638;











