Упрочняющие фазы металлоидного типа.
Для получения поверхностных слоев различного назначения в настоящее время широко используют металлоидные соединения типа карбидов, боридов, нитридов, оксидов и др. Физико-химические свойства соединений металлоидной группы весьма разнообразны.
Карбиды.
Карбиды представляют собой химические соединения металлов с углеродом. Карбиды – это широкий класс материалов, многие их которых имеют высокую температуру плавления, высокую твердость, как при нормальных, так и при повышенных температурах, жаростойкость к агрессивным средам и пр. Свойства некоторых карбидов представлены в таблице 13.1.
Таблица 13.1. Свойства карбидов.
| Карбид | βMo 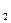 C C
| γW 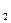 C C
| TiC |
Температура плавления, Т 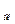 , °С , °С
| |||
| Твердость, HRA |
По степени возрастания сродства к углероду металлы можно расположить в следующий ряд: Fe, Mn, Cr, Mo, W, V, Ti, Nb.
В зависимости от расположения атомов углерода в кристаллической решетке карбидов их разделяют на 3 основные группы:
1. Карбиды с кубической кристаллической решеткой (карбид титана TiC, карбид циркония ZrC и др.).
Атомы углерода располагаются в промежутках между атомами металлов, образуют фазы внедрения. Многие карбиды, имеющие кубическую решетку, обладают широкими областями гомогенности. Этим объясняется, что удаление ряда атомов углерода из решетки карбида не приводит к разрушению соединения и существенному изменению его свойств.
Например, в TiC содержание углерода может изменяться от 20 до 50% (атомарных) без значительного изменения вида и свойств кристаллической решетки. Однако появляется возможность замещения недостающих атомов углерода в карбиде другими атомами (кислорода, азота и др.).
2. Карбиды с гексагональной кристаллической решеткой (карбид вольфрама W 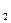 C, карбид молибдена Mo
C, карбид молибдена Mo 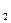 C и др.).
C и др.).
Многие свойства аналогичны карбидам с кубической решеткой. Однако кристаллическая решетка неустойчива при удалении из нее атомов углерода.
3. Карбиды со сложной структурой (карбид хрома Cr 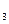 C
C 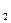 ; карбид ниобия α - Nb
; карбид ниобия α - Nb 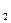 C и др.).
C и др.).
Атомы углерода расположены не изолированно один от другого, как это было в предыдущих группах, а образуют цепочки, пронизывающие решетку металлических атомов. Такие структуры часто называют ромбическими (орторомбическими - Cr 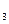 C
C 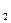 ; ромбоэдрическими - В
; ромбоэдрическими - В 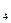 С).
С).
При полном расплавлении многие высшие карбиды переходят в низшие. При этом углерод выделяется в форме графита:
(МеС)высший → (МеС)низший + Сграфит
Карбиды бора и кремния несмотря на высокую твердость не получили широкого распространения в покрытиях, так как при высоких температурах диссоциируют без расплавления.
При высоких температурах карбиды интенсивно окисляются. Температуры активного окисления приведены в таблице 13.2.
Таблица 13.2. Температуры активного окисления карбидов.
| Карбид | WC, Mo 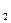 С С
| В 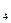 С С
| Cr 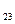 С С 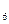 ,
Cr ,
Cr 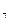 С С 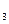 , Cr , Cr 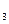 С С 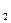
| TiC | ZrC |
| Т, К | 1300-1500 |
Невысокое сопротивление окислению у карбидов ванадия, ниобия, молибдена и вольфрама объясняется образованием на их поверхности легкоплавкой летучей оксидной пленки.
При окислении карбидов титана, циркония, кремния, хрома на поверхности образуется защитная пленка из прочных оксидов, затрудняющая окисление в глубине.
Чисто карбидные покрытия отличаются высокой хрупкостью, поэтому в покрытия, содержащие карбиды в качестве связки, вводят материалы, обладающие достаточно высокой пластичностью.
Дата добавления: 2016-10-26; просмотров: 1975;











