Второй закон термодинамики
Все реальные процессы не являются равновесными и протекают с конечной скоростью, приближая систему к равновесию. В момент наступления равновесия процесс заканчивается. Неравновесный процесс, протекающий в направлении достижения равновесия без воздействия внешних условий, называется самопроизвольным (положительным). Обратный по направлению процесс, который не может протекать без внешних воздействий и удаляющий систему от равновесия называется несамопроизвольным (отрицательным).
II закон термодинамики позволяет предсказать направление протекания процесса и формулируется следующим образом:
Вечный двигатель второго рода невозможен, т.е. невозможно построить такую машину, которая производила бы работу за счет тепла окружающей среды, не более нагретой, чем сама машина.
Т.о., процесс превращения теплоты в работу является несамопроизвольным и для его проведения необходима специальная организация такого процесса (паровая машина). КПД такой машины - отношение совершенной работы к затраченной теплоте: η =  .
.
ЭнтропиЯ
Энтропия – функция состояния термодинамической системы, изменение которой определяется отношением количества теплоты, сообщенного системе или отведенного от нее, к температуре системы: 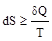
где знак равенства относится к равновесному процессу, неравенства – к неравновесному. Т.о. в равновесном процессе: DS = 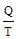 .
.
Если энтропия увеличивается (DS > 0), то самопроизвольный неравновесный процесс возможен, если DS < 0 – невозможен.
Изменение энтропии в сложной системе или сложном процессе складывается из изменений ее в отдельных частях системы или в отдельных стадиях процесса, т.е.
DS = S1 + S2….+ Si.
Дата добавления: 2016-10-26; просмотров: 1161;











