Способы выражения концентрации растворов.
Растворитель обычно называют первым компонентом (индекс 1), а растворенное вещество – вторым, третьим и т.д. (индекс 2, 3 и т. д.).
Массовая доля компонента (wi) - это отношение массы данного компонента к массе раствора, которая в процентах определяется соотношением:
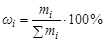 ,
,
где 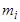 - масса растворенного вещества, а
- масса растворенного вещества, а 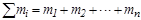 - суммарная масса всех компонентов раствора. Для бинарной системы
- суммарная масса всех компонентов раствора. Для бинарной системы
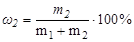
Мольность (С) определяется числом моль вещества в единице объема раствора.
С= 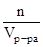 , моль/м3.
, моль/м3.
Молярная концентрация или молярность (СМ) равна числу моль растворенного вещества, содержащихся в 1 л раствора.
См= 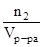 , моль/л (М, например, 2М – двухмолярный раствор).
, моль/л (М, например, 2М – двухмолярный раствор).
Эквивалентная концентрация или нормальность (СН) равна числу моль-эквивалентов растворенного вещества, содержащихся в 1 л раствора.
СН= 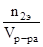 , n2э – число моль-эквивалентов в единице объема.
, n2э – число моль-эквивалентов в единице объема.
СН= 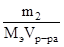 , m2 – масса растворенного вещества, г; Мэ – эквивалентная масса растворенного вещества, г/моль-экв.
, m2 – масса растворенного вещества, г; Мэ – эквивалентная масса растворенного вещества, г/моль-экв.
СН измеряется в моль-экв/л (Н, например, 2Н – двухнормальный раствор).
Моляльная концентрация или моляльность (Сm) равна числу моль растворенного вещества в 1000 г растворителя. Если раствор состоит только из растворенного вещества и растворителя, моляльность растворенного вещества обозначают Сm,2. Ее можно рассчитать по формуле
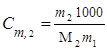 ,
,
где m1 и m2 – массы растворителя и растворенного вещества соответственно, М2 - молярная масса растворенного вещества. Так как количество вещества в молях 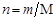 , то
, то
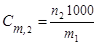 ,
,
где n2 – количество моль растворенного вещества в m1 граммах растворителя.
Мольной долей (хi) компонента называется число молей компонента, приходящихся на один моль раствора. Мольная доля i-го компонента равна отношению числа молей i-го компонента ( 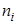 ) к сумме чисел молей всех компонентов в растворе (
) к сумме чисел молей всех компонентов в растворе ( 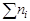 ) и определяется соотношением:
) и определяется соотношением:
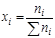 ,
,
где 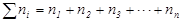
Если раствор состоит только из растворенного вещества и растворителя, мольную долю растворенного вещества обозначают х2, а растворителя – х1.
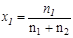
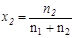
При любом количестве компонентов раствора сумма мольных долей всех компонентов равна 1: 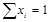 , тогда для бинарного раствора
, тогда для бинарного раствора 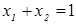
Задание. При 20°С 20% ный раствор серной кислоты имеет плотность 1,139 г/мл. Выразить концентрацию водного раствора через молярность, нормальность, моляльность и мольные доли. Массу раствора принять равной 100 г.
1. Рассчитываем молярность:
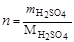 ;
; 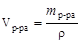 ,
,
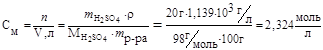
2. Рассчитываем нормальность раствора кислоты.
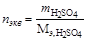 , тогда
, тогда
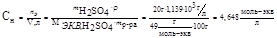
Следует иметь в виду, что так как 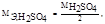 то СН = 2СМ
то СН = 2СМ
3. Моляльность:
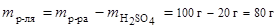 ,
,
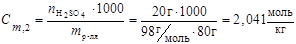
4. Мольная доля:
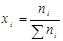 ;
; 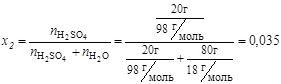
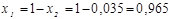
Дата добавления: 2016-10-26; просмотров: 1809;











