Химическая кинетика
Количественной характеристикой быстроты течения химической реакции является ее скорость. За скорость химической реакции принимают изменение количества реагирующего вещества (или продукта) во времени в единице объема реакционной системы. Учение о механизмах и скоростях химических реакций называется химической кинетикой.
Например, Ai – одно из реагирующих веществ или продуктов реакции. В момент времени t1, в объеме V содержалось вещество A количеством n1(Ai), в момент времени t2 в том же объеме количество вещества A равно n2(Ai). Тогда скорость реакции u по веществу Ai составит:
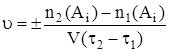
Введем обозначения: 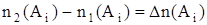 - изменение количества вещества Ai;
- изменение количества вещества Ai; 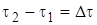 - промежуток (изменение) времени и, подставив их в уравнение, получаем
- промежуток (изменение) времени и, подставив их в уравнение, получаем
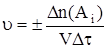
Учитывая, что
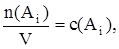
получаем
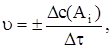
где c(Ai) – молярная концентрация – количество вещества, содержащееся в единице объема, моль/л или моль/м3.
Таким образом, скорость реакции – это изменение концентрации реагирующего вещества в единицу времени. Единица измерения скорости – моль/(м3´с) или моль/(л´с).
Скорость химической реакции зависит от нескольких факторов.
1. Природа реагентов. Энергией активации Еа (в кДж/моль) называют избыточную энергию, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества. Еа различных реакций различна. Посредством этого фактора сказывается влияние природы реагирующих веществ на vх.р.. Если Еа<40 кДж/моль (т.е. мала), то скорость такой реакции велика (например, ионные реакции в растворах, протекающие практически мгновенно). Если Еа>120 кДж/моль (т.е. очень значительна), то скорость такой реакции незначительна (например, реакция синтеза аммиака N2+3H2=2NH3 – скорость этой реакции при обычных Т вследствии высоких значений Еа настолько мала, что заметить её протекание практически невозможно).
В 1889 г. знаменитый шведский химик Аррениус вывел из опытных данных уравнение, связывающее константу скорости с температурой и энергией активации. Позднее это уравнение получило теоретическое обоснование. Согласно Аррениусу, константа скорости находится в экспоненциальной зависимости от температуры: k=kmax×exp(-Ea/RT), где R - универсальная газовая постоянная, равная 8,31 Дж/моль×К; kmax - предэкспоненциальный фактор, имеющий смысл максимально возможного значения константы скорости при нулевой энергии активации или бесконечно высокой температуре, когда все столкновения молекул реагентов становятся активными. Уравнение Аррениуса используют чаще в логарифмической форме: lnk=lnkmax-Ea/RT.
2. Концентрация реагирующих веществ. В соответствии с основным законом химической кинетики для реакции
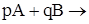 продукты
продукты
скорость выражается следующим соотношением:
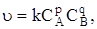
где k – константа скорости реакции; p и q – коэффициенты (определяются экспериментально). Для некоторых простейших реакций коэффициенты p и q равны стехиометрическим коэффициентам уравнения реакции. Например, для реакции
H2(г) + I2(г) ® 2HI(г)
можно записать
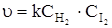
т.е. 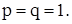
3. Температура реакции. Зависимость скорости реакции от температуры передается уравнением Вант-Гоффа:
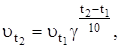
где 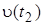 и
и 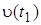 - скорости реакции при температурах t2 и t1; g - температурный коэффициент скорости реакции (для многих реакций
- скорости реакции при температурах t2 и t1; g - температурный коэффициент скорости реакции (для многих реакций
g = 2…4). Это правило говорит о том, что скорость реакций возрастает в 2 - 4 раза при увеличении температуры на 100C.
4. Поверхность соприкосновения реагентов. Чем больше поверхность соприкосновения реагирующих веществ, тем быстрее протекает реакция. Реакция в растворах протекает практически мгновенно.
5. Катализаторы – это вещества, не расходующиеся в реакции, но оказывающие влияние на её скорость. Явление изменения скорости реакции под действием катализаторов называется катализом, а сами эти реакции являются каталитическими. Действие катализатора обусловлено снижением величины энергии активации. Под воздействием катализаторов реакции могут ускоряться в миллионы и более раз.
Различают гомогенный и гетерогенный катализ. При гомогенном катализе катализатор и реагенты образуют одну фазу (газ или раствор), а при гетерогенном катализе – катализатор находится в системе в виде самостоятельной фазы. Примером гомогенного катализа служит разложение перекиси водорода на воду и кислород в присутствии катализаторов К2Cr2O7, К2WO4 и др. Примером гетерогенного катализа является окисление диоксида серы в триоксид при контактном способе получения серной кислоты из отходящих газов металлургических производств: SO2+0,5O2+H2O=(NO2)=H2SO4.
Задание. В сосуде вместимостью 2 л смешали 4,5 моль газа А и
3 моль газа В. Газы А и В реагируют в соответствии с уравнением
А + В = 2С.
Через 2 с в реакционной системе образовался газ С количеством вещества 1 моль. Определите среднюю скорость реакции. Рассчитайте количества веществ газов А и В, которые не прореагировали.
Дано:
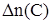 = 1 моль = 1 моль
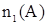 = 4,5 моль = 4,5 моль
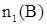 = 3 моль
V = 2 л = 3 моль
V = 2 л
 = 2 с = 2 с
| Решение:
1.Из уравнения реакции следует, что
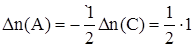 моль = 0,5 моль,
где моль = 0,5 моль,
где 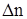 - изменение количества вещества в ходе реакции, знак «-» означает, что вещество А расходуется в ходе реакции.
2. Аналогично получаем для вещества В - изменение количества вещества в ходе реакции, знак «-» означает, что вещество А расходуется в ходе реакции.
2. Аналогично получаем для вещества В
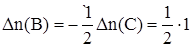 моль = 0,5моль.
3. Вычисляем количество вещества А, которое вступило в реакцию: моль = 0,5моль.
3. Вычисляем количество вещества А, которое вступило в реакцию:
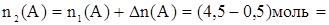 4 моль
4. Количество вещества В, которое осталось в реакционной смеси, равно: 4 моль
4. Количество вещества В, которое осталось в реакционной смеси, равно:
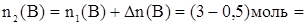 2,5 моль
5. Среднюю скорость реакции за данный промежуток времени вычисляем по формуле 2,5 моль
5. Среднюю скорость реакции за данный промежуток времени вычисляем по формуле
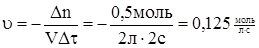 Ответ: 4 моль, 2,5 моль, 0,125
Ответ: 4 моль, 2,5 моль, 0,125 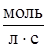
|
Задание. Во сколько раз увеличится скорость реакции
H2 + I2 = 2HI,
если увеличить количества вещества иода и водорода в реакционной системе в два раза при постоянном объеме.
Дано:
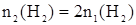 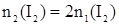

| Решение:
В соответствии с основным законом химической кинетики:
 Аналогично для скорости u2, когда количества реагентов увеличились, имеем:
Аналогично для скорости u2, когда количества реагентов увеличились, имеем:
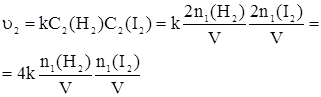 Определяем, во сколько раз увеличилась скорость реакции
Определяем, во сколько раз увеличилась скорость реакции
  Ответ: Скорость реакции увеличится в 4 раза.
Ответ: Скорость реакции увеличится в 4 раза.
|
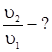
| |
Задание. Реакция при температуре 50 °С протекает за 2 мин 15 с. За сколько времени закончится эта реакция при 70 °С, если в данном температурном интервале температурный коэффициент скорости реакции равен 3?
Дано:
t1 = 500C
t2 = 700C
Dt1= 2 мин.15с =
=135 с
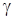 = 3 = 3
| Решение:
1. С использованием правила Вант-Гоффа вычисляем, во сколько раз увеличится скорость реакции при увеличении температуры с 50 до 700С
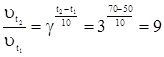 2. По определению скорости
2. По определению скорости
 ; ; 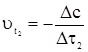 Так как при обеих температурах
Так как при обеих температурах 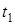 и и 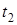 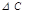 одинаково, получаем: одинаково, получаем:
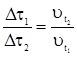 ; ;  3. Вычисляем время, за которое реакция произойдет при температуре 700C:
3. Вычисляем время, за которое реакция произойдет при температуре 700C:
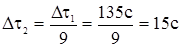 Ответ: 15 с.
Ответ: 15 с.
|
Дата добавления: 2016-10-26; просмотров: 1645;











