Характеристики ионной связи
1. Направленность в пространстве. Каждый ион представляет собой как бы заряженный шар, который может притягивать ионы противоположного знака по любому напрвлению.
2. Ненасыщаемость – взаимодействие ионов противоположного знака не приводит к компенсации силовых полей. Способность притягивать ионы противоположного знака у них остается и по другим направлениям. Взаимодействие с ними будет энергетически равноценным.
Водородная связь
Водородная связь возникает между двумя электроотрицательными атомами одной или нескольких разных молекул при помощи атома водорода.
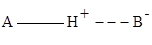
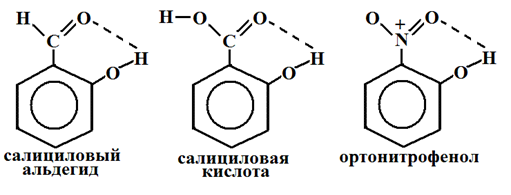
Чертой обозначена ковалентная связь, пунктиром – водородная связь. Для водородной связи характерно электростатическое притяжение водорода (несущего положительный заряд) к атому электроотрицательного элемента В, имеющего отрицательный заряд. Водородная связь слабее ковалентной, но сильнее обычного притяжения молекул друг к другу. Водородная связь считается разновидностью ковалентной химической связи по донорно-акцепторному механизму.
Водородная связь может быть межмолекулярной и внутримолекулярной. Внутримолекулярная водородная связь – водородная связь, объединяющая части одной молекулы.
Межмолекулярная водородная связь – водородная связь, образующаяся между атомом водорода одной молекулы и атомом неметалла другой молекулы. В результате этого молекулы объединяются в ассоциаты: димеры, тримеры и полимеры (димеры воды и уксусной кислоты).
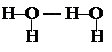
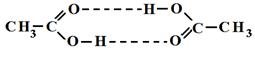
Наличие водородных связей приводит к возрастанию плотности, температуры кипения и плавления, вязкости веществ.
Дата добавления: 2016-10-26; просмотров: 2900;











