Кристаллические решетки
Кристаллы каждого вещества имеют характерную форму (кристаллы хлорида натрия NaCl имеют форму куба, кристаллы сульфата калия K2SO4 — форму ромба, нитрата кальция Ca(NO3)2 – октаэдров).
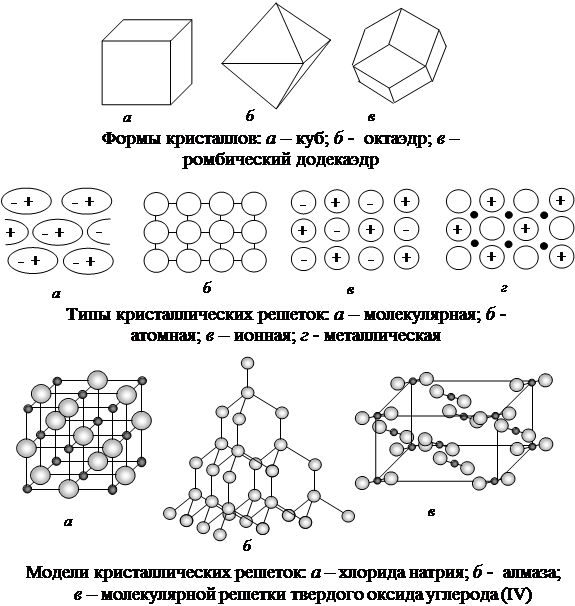 |
В узлах ионной решетки расположены положительные и отрицательные ионы. Вокруг каждого положительного иона располагаются отрицательные ионы, а вокруг отрицательного иона – положительные. Например, в кристаллической решетке хлорида натрия каждый ион С1- окружают шесть ионов Na+, а каждый ион Na+ – шесть хлорид-ионов.
Число частиц (атомов, молекул, ионов), которые окружают данную частицу в кристаллической решетке или в молекуле, называется координационным числом.
Все ионные соединения имеют высокую температуру плавления и нелетучи.
В узлах атомной решетки располагаются атомы, связанные между собой электронными парами (кристаллы алмаза). Для веществ с атомной решеткой характерны высокая твердость и высокие температуры плавления.
В узлах молекулярной решетки располагаются полярные или неполярные молекулы. Они связаны между собой более слабыми силами, чем атомы или ионы. Поэтому вещества с молекулярными решетками имеют сравнительно невысокую температуру плавления, они летучи (сахар, вода, аммиак).
В узлах металлической решетки располагаются нейтральные атомы и положительные ионы данного металла. Между ними свободно перемещаются электроны. Этим обусловлены общие свойства металлов: металлический блеск, пластичность, электрическая проводимость и теплопроводность.
ХИМИЧЕСКИЕ РЕАКЦИИ И ЗАКОНОМЕРНОСТИ
ИХ ПРОТЕКАНИЯ
Химические свойства веществ проявляются в химических реакциях. Химическая реакция изображается в общем виде уравнением
aA + bB = cC + dD,
где вещества А и В, вступающие в реакцию, называют реагентами (или исходными веществами), а новые вещества C и D, образующиеся в результате протекания реакции, - продуктами (или конечными веществами). Целочисленные параметры a, b, c и d в уравнении реакции называют стехиометрическими коэффициентами.
Дата добавления: 2016-10-26; просмотров: 1726;











