АНИЛИН. Эксперимент с ним
Опыты с анилином должны показать, что это вещество принадлежит к классу аминов, имеет свойства основания и в то же время отличается от алифатических (жирных) аминов по степени проявления основных свойств. Большое внимание также должно быть уделено получению анилина из нитробензола ввиду особого исторического значения этой реакции и ее роли в современной промышленности.
Постановка опыта получения анилина из нитробензола с выделением продукта требует длительного времени. Поэтому он может быть поставлен или с помощью приемов, рекомендуемых для демонстрации длительных опытов, или без выделения продукта. При этом ограничиваются констатацией появления нового вещества с помощью качественной реакции. Более полный опыт с извлечением анилина переносится на практические занятия.
Ввиду ядовитости паров анилина при работе с ним должны соблюдаться меры предосторожности. Опыты по возможности следует проводить в вытяжном шкафу.
Отношение анилина к индикаторам. После ознакомления с физическими свойствами, составом и строением анилина, естественно, встает вопрос о том, что это вещество должно иметь химические свойства, сходные со свойствами рассмотренных ранее жирных аминов. С целью проверки этого предположения исследуют отношение анилина к индикаторам.
К 100 мл воды прибавляют 1 мл анилина и взбалтывают смесь стеклянной палочкой. Половину раствора отливают в другой стакан и прибавляют в один из них фенолфталеин, а в другой — лакмус. Окраска индикаторов не изменяется.
Взаимодействие анилина с кислотами. После того как показано, что анилин не действует на индикаторы, т.е. не обладает основными свойствами, возникает вопрос, способен ли он к солеобразованию.
а) В пробирку с 5 мл воды учащиеся наливают около 0,3 мл анилина. Смесь взбалтывают. Убеждаются, что анилин почти не растворился в воде. Добавляют по каплям концентрированную соляную кислоту. Анилин растворяется. Составляют уравнение реакции образования соли.
К. раствору соли анилина добавляют по каплям концентрированный раствор щелочи. Снова выделяется анилин в виде маслянистой жидкости. Составляют уравнение реакции.
При проведении опыта следует пользоваться концентрированными растворами кислоты и щелочи с той целью, чтобы не вводить большого количества воды, иначе из-за частичной растворимости анилина (1 г анилина растворяется в 30 мл воды) выделение его будет малозаметно.
б) В демонстрационную пробирку наливают 5 мл анилина и затем примерно такой же объем концентрированной соляной кислоты или 50-процентной серной кислоты. Дают некоторым учащимся убедиться, что проходит экзотермическая реакция. Охлаждают пробирку в струе холодной воды. Выделяются кристаллы соли. Растворяют соль по возможности в небольшом количестве воды (воду добавляют небольшими порциями и пробирку встряхивают). Если остался непрореагировавший анилин, отфильтровывают от него раствор, а к раствору соли добавляют концентрированный раствор щелочи. Выделяется свободный анилин.
Тем или другим из этих опытов устанавливается, что анилин является основанием; отсутствие же действия его на индикаторы говорит о том, что он основание более слабое, чем жирные амины.
Так как по составу молекул жирные амины и анилин отличаются тем, что вместо предельного радикала здесь имеется бен-
зольное ядро, то очевидно, что ослабление основных свойств аминогруппы обусловлено влиянием ароматического кольца.
Взаимодействие анилина с бромной водой. Как известно, влияние атомов друг на друга в молекуле взаимно. Если бензольное кольцо влияет на аминогруппу в анилине, ослабляя проявление се свойств основания, то можно ожидать, что и бензольное ядро под влиянием этой группы будет обладать свойствами, отличными от свойств бензола. С подобным изменением свойств ядра учащиеся уже встречались на примере фенола.
Встает вопрос, не ослабляет ли аминогруппа связь атомов водорода с ядром, подобно тому как эту связь ослабляет гидроксильная группа в феноле, и не будет ли анилин реагировать с бромной водой, как реагирует с ней фенол.
В колбе или демонстрационной пробирке растворяют при встряхивании и 10 мл воды I мл анилина. К полученному раствору (эмульсии) добавляют бромную воду до образования белого осадка.
Осадок представляет собой триброманилин:
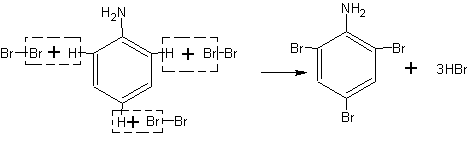
Для успеха опыта необходимо, чтобы растворы анилина и брома были достаточно концентрированными. Вместо раствора анилина можно воспользоваться раствором его соли.
Окисление анилина. Анилин сравнительно легко окисляется в разнообразные продукты. Окислением анилина, в частности, объясняется потемнение его при хранении в плохо закрываемых склянках. При окислении анилина хромовой смесью и некоторыми другими сильными окислителями образуется так называемый черный анилин, применяемый для окраски в черный цвет тканей, дерева, кожи.
а) В демонстрационной пробирке к 3-4 мл водной эмульсии анилина приливают 10—12 мл хромовой смеси. Жидкость взбалтывают и подогревают. Вначале она приобретает зеленую окраску. затем синеет, при дальнейшем нагревании образуется осадок черного анилина. Характер осадка выявляется при сильном взбалтывании смеси в пробирке.
б) В 100 мл воды растворяют 2 г двухромовокислого калия К2Сг2О7 и 1 мл концентрированной серной кислоты. К полученному раствору добавляют 2 г хлорида анилина или по 1 мл анили-
на и концентрированной соляной кислоты. Смесь перемешивают стеклянной палочкой. В образующийся раствор быстро вносят кусок хлопчатобумажной ткани. Краситель с тканью нагревают, затем ткань достают, отжимают валиком на гладкой поверхности и развешивают на стеклянных палочках.
в) Готовят раствор хлорида анилина, приливая к 50 мл воды 2 мл анилина и 3 мл концентрированной соляной кислоты. Затем к реакционной смеси добавляют еще 1 г хлорида аммония. Полученный раствор наносят кисточкой на гладкую поверхность доски.
После того как раствор впитается, таким же способом покрывают дерево вторым раствором, приготовляемым растворением 4 г бертолетовой соли и 6 г медного купороса в 50 мл воды. Бертолетова соль окисляет анилин, и поверхность доски постепенно приобретает черную окраску. Хлорид аммония и сульфат меди способствуют ускорению процесса окисления и получению плотной и прочной окраски. После высыхания поверхности на нее еще несколько раз наносят попеременно первый и второй растворы.
Получение анилина. Производство анилина долгое время было основано только на восстановлении нитробензола. Эта реакция была открыта знаменитым русским ученым Н.И.Зиминым.
В промышленном способе производства для восстановления нитробензола используются соляная кислота и железные или чугунные опилки. Все эти вещества загружаются в реактор, образующийся водород в момент выделения энергично восстанавливает нитробензол в анилин.
В школьных опытах получения анилина для ускорения реакции вместо железа используют обычно олово или цинк. Соображения экономического характера при таких незначительных масштабах здесь не играют роли. Опыт с железом может быть перенесен на практические занятия или в химический кружок и поставлен там не только для иллюстрации основной химической реакции, но и с целью отражения важнейших производственных операций.
а) В колбочку емкостью 100 мл вносят 2-3 капли нитробензола, приливают 1—2 мл концентрированной соляной кислоты и вносят 2-3 маленьких кусочка цинка (или олова). Если реакция пойдет слишком бурно, колбочку охлаждают в струе холодной воды или в стакане с водой. Когда запах нитробензола исчезнет или почти исчезнет, в колбу приливают концентрированный раствор щелочи (30-40-процентной) до тех пор, пока образующийся вначале осадок гидроксида цинка Zn(OH)2 ввиду своей амфотерности не растворится при дальнейшем прибавлении щелочи:
Zn(OH)2 + 2NaOH à Na2ZnO2 + 2H2O
Это будет гарантией того, что щелочь выделит анилин из соли.
Чтобы констатировать образование анилина, присоединяют к колбе холодильник и отгоняют около 0,5-1 мл жидкости. Анилин гонится вместе с парами воды в виде белой эмульсии. Затем дистиллят разбавляют водой, чтобы анилин растворился, и открывают его с помощью бромной воды. Одновременно убеждаются, что нитробензол не взаимодействует с бромной водой.
б) Препарат анилина для классных занятий может быть получен в опыте, более точно воспроизводящем промышленный способ, чем предыдущие.
В заводской практике для восстановления нитробензола берут значительно меньше соляной кислоты, чем соответствует уравнению
С6Н5NО2 + 6Н à C6H5NH2 + 2Н2О,
так как образующийся хлорид железа катализирует реакцию:
С6Н5NO2 + 2Fe + 4Н2O à 2Fe(OH)3 + C6H5NH2
В условиях школьного опыта, при работе с меньшими массами веществ, лучше брать количества, близкие к теоретическим.
В большую круглодонную колбу помещают 15—20 г нитробензола, 50 г железных опилок или мелких стружек и приливают небольшими порциями (сначала по 3-5 мл) 80—100 мл концентрированной соляной кислоты. После каждой добавки кислоты колбу закрывают пробкой с обратным воздушным холодильником для конденсации паров нитробензола и встряхивают. В случае слишком бурного течения реакции колбу непродолжительное время охлаждают в холодной воде. После того как будет введена вся кислота и реакция через некоторое время начнет затихать, колбу в течение 20—30 мин подогревают на асбестовой сетке. По исчезновению в колбе запаха нитробензола судят о полном восстановлении. Этот процесс требует обычно не менее часа.
Для выделения анилина из соли жидкость переливают в колбу для перегонки, добавляют к раствору понемногу концентрированной щелочи. При этом образуется осадок гидроксида железа (III). Прибавлять щелочь следует до сильнощелочной реакции (проба лакмусовой бумажкой), тогда избыток щелочи выделит анилин из соли.
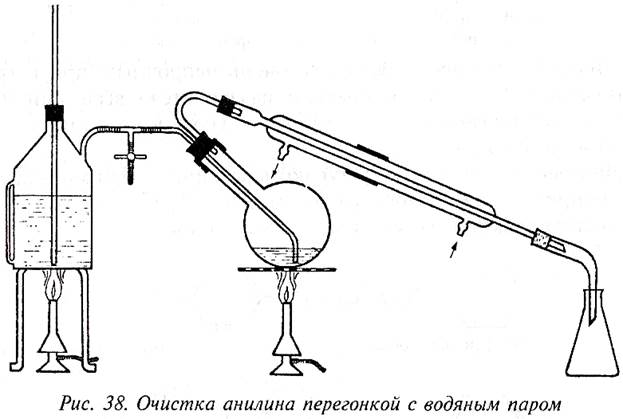
Собирают прибор для перегонки с водяным паром (рис. 38).
Чтобы вода в парообразователе кипела без толчков, его снабжают предохранительной трубкой, доходящей до дна. Одновременно с парообразователем нагревают и колбу с анилином, чтобы поступающие пары воды в ней не конденсировались. Отгоняющийся анилин образует в приемнике водную эмульсию и частично соби-
рается в виде маслянистого слоя. Перегонку ведут до тех пор, пока в приемник не начнут падать капли совершенно прозрачной жидкости, что свидетельствует о том, что перегоняется чистая вода.
Дистиллят насыщают поваренной солью. Анилин нерастворим в насыщенном растворе хлорида натрия, поэтому жидкость расслаивается. Анилин отделяют с помощью делительной воронки, сушат небольшим количеством твердого гидроксида натрия или калия и перегоняют из небольшой колбочки с воздушным холодильником (темп. кип. 184°С).
Собирается довольно чистый продукт, в дальнейшем изменяющий окраску под действием кислорода воздуха. Полученного количества анилина вполне достаточно для постановки опытов с ним в нескольких классах.
Дата добавления: 2018-11-26; просмотров: 2147;











