КЛЕТЧАТКА (ЦЕЛЛЮЛОЗА)
Основная идея опытов по данному разделу — показать разнообразные применения клетчатки, основанные на использовании ее химических свойств. В связи с этим опыты подразделяются па три основные группы: а) гидролиз клетчатки, вскрывающий принадлежность ее к классу углеводов и иллюстрирующий основной процесс современной гидролизной промышленности; б) нитрование клетчатки, показывающее использование ее для производства взрывчатых веществ.
Из сказанного видно, что материал данного раздела имеет существенное значение для практического ознакомления учащихся с научными основами современных химических производств.
Гидролиз клетчатки до глюкозы. Одним из характерных и практически важных свойств клетчатки как представителя полисахаридов является ее гидролиз до более простых продуктов.
Конечным продуктом гидролиза клетчатки, как и крахмала, является глюкоза:
(С6Н12O6)n + nH2O à С6Н12O6
Гидролиз клетчатки также катализируется минеральными кислотами.
В настоящее время в промышленности гидролизом клетчатки (преимущественно древесины) и последующим сбраживанием образующейся глюкозы получают этиловый спирт и другие продукты.
Опыты по гидролизу могут ставиться с различной полнотой: от констатации наличия глюкозы в гидролизате до извлечения глюкозы в твердом виде.
а) В ступке смачивают кусочек чистой фильтровальной бумаги или ваты концентрированной серной кислотой и растирают пестиком. Полученный раствор переносят в демонстрационную пробирку или химический стакан с небольшим количеством воды (2-3 мл) и кипятят в течение 5 мин. После этого часть раствора нейтрализуют щелочью и нагревают с фелинговой жидкостью. Образование красного оксида меди (I) указывает на появление глюкозы.
Параллельно можно провести контрольный опыт: кипятить столько же времени фильтровальную бумагу или вату с водой без кислоты. При последующем нагревании этой жидкости с фелинговым раствором осадок оксида меди (I) не образуется.
б) Для демонстрации процесса гидролиза клетчатки можно воспользоваться древесными опилками. Этот опыт будет поучительнее предыдущего, так как с большим приближением иллюстрирует современное гидролизное производство.
1—2 г древесных опилок смачивают в химическом стакане водой, прибавляют 2—3 мл концентрированной серной кислоты, затем 30—50 мл воды и кипятят 8—10 мин. После этого часть еще горячего раствора фильтруют через складчатый фильтр, фильтрат нейтрализуют щелочью и нагревают с фелинговым раствором. Образуется красный оксид меди (1).
Параллельно может быть поставлен опыт нагревания опилок с водой без кислоты. Получающийся в этом случае раствор не дает с фелинговой жидкостью оксид меди (I).
Время, в течение которого идет кипячение смеси опилок с кислотой, может быть использовано для разъяснения учащимся сущности гидролизного производства и его значения.
в) Предыдущие опыты дают представление о реакции гидролиза клетчатки и о получаемом продукте, но еще не знакомят с основными стадиями гидролизного производства. Как показала практика, в школьных условиях можно поставить опыт, более полно отражающий промышленный способ осахаривания древесины.
Ввиду длительного времени некоторые операции опыта (нейтрализация кислоты и фильтрование) можно выполнить вне урока.
Наиболее распространенный в промышленности способ осахаривания древесины состоит в нагревании ее с очень разбавленной серной кислотой (0,5%) под давлением до 10 ат. В школе, естественно, нельзя поставить опыт с применением автоклава, да в этом и нет особой необходимости, так как не ставится задача получения максимально возможного выхода глюкозы. Зато можно несколько повысить концентрацию серной кислоты, чтобы ускорить процесс.
К 1-1,5 г древесных опилок в колбе прибавляют 14 мл серной кислоты (6 мл воды и 8 мл концентрированной серной кислоты). Смесь встряхивают примерно в течение 10 мин, одновременно прогревая ее немного в пламени спиртовки. Затем к ней приливают 150—200 мл воды, закрывают колбу пробкой с обратным холодильником и кипятят в течение 10-15 мин.
Раствор фильтруют в большую коническую колбу. К фильтрату добавляют небольшими порциями тонко измельченный мел, все время энергично круговыми движениями перемешивая смесь до тех пор, пока не прекратится выделение углекислого газа (шипение) и лакмусовая бумажка не покажет, что серная кислота нейтрализована:
СаСО3 + H2SO4 à- CaSO4 + Н2О + СО2
Вместо мела можно применить известковое молоко или баритовую воду.
Раствор фильтруют от обильного осадка сульфата кальция. С помощью фелингова раствора убеждаются в наличии глюкозы в фильтрате. Упаривают раствор в фарфоровой чашке на водяной бане до небольшого объема жидкости.
Так как фильтрование и упаривание занимают много времени, то эта часть опыта может быть поставлена в двух вариантах: учащимся сообщается, что эти операции будут выполнены после урока и на следующем занятии из концентрированного раствора будет извлечен сахар, или же берется упаренный раствор, заранее подготовленный учащимися в кружке. Второй путь более удобный, так как не нарушает логической стройности урока и ведет к лучшим результатам. Последнее объясняется тем, что в процессе внеклассной работы учащиеся могут продолжительное время обрабатывать опилки слабо разбавленной кислотой (от 2 ч до суток) и длительное время кипятить их с сильно разбавленной кислотой (до 2 ч), что приведет к большему выходу продукта.
Сконцентрированный раствор глюкозы выпаривают в фарфоровой чашке на водяной бане. При этом следят за тем, чтобы выделяющийся сахар по возможности не подгорал. На дне чашки по мере испарения воды образуется немного глюкозы, обычно светло-желтого цвета (вследствие частичного разложения органических примесей). Полученный продукт можно испробовать на вкус — учащиеся убеждаются в его сладком вкусе. В классе ощущается запах горелого сахара, так как при выпаривании без вакуума не удается избежать частичного разложения. Растворив полученный продукт в воде и добавив дрожжей, в соответствующих условиях можно наблюдать реакцию брожения (по выделению углекислого газа), что подтверждает образование сахара из древесины.
Нитрование клетчатки и опыты с нитроклетчаткой. В зависимости от концентрации применяемой азотной кислоты и времени нитрования получаются, как известно, различные продукты. Для полного нитрования клетчатки в соответствии с уравнением нужна дымящая азотная кислота (уд. вес 1,52), которой обычно школы не располагают.
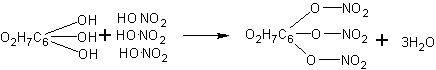
В случае применения азотной кислоты удельного веса 1,4 нитрование обычно не доходит до образования тринитроклетчатки. Однако с полученным продуктом удается проделать все необходимые опыты, иллюстрирующие свойства нитроклетчатки.
В химическом стаканчике готовят смесь 5 мл концентрирован-
ной азотной кислоты (уд. вес 1,4) и 10 мл концентрированной серной кислоты (уд. вес 1,84). После того как смесь примет комнатную температуру, в нее погружают минут на 10—15 комочек ваты, перемешивая его с кислотами стеклянной палочкой. Затем вату промывают водой в большом химическом стакане и в струе под водопроводным краном. После этого нитроклетчатку отжимают и высушивают в листах фильтровальной бумаги, неоднократно меняя их и разрыхляя каждый раз вату.
Полного высушивания нитрованной ваты на уроке не достичь; однако дальнейшие опыты удаются и со слегка влажной нитроклетчаткой. Можно также взять для опытов ранее заготовленную нитроклетчатку.
а) Горение нитроклетчатки. В пламени спиртовки поджигают одновременно небольшой комочек ваты и полученного нитропродукта (взятые в щипцы). Первый образец горит медленно, второй сгорает моментально.
Головку одной спички обертывают ватой, другой спички — нитроклетчаткой. Вату и нитроклетчатку поджигают. Вслед за горением ваты спичка вспыхивает, нитроклетчатка же сгорает настолько быстро, что спичка не успевает воспламениться.
б) Получение бездымного пороха. Немного нитроклетчатки в стакане смачивают этилацетатом или ацетоном до образования студенистой массы. После высыхания образуется бездымный порох. Извлекают часть его и поджигают. Горение происходит менее интенсивно, чем у нитроклетчатки.
АМИНЫ. КРАСИТЕЛИ
Изучению аминов в курсе органической химии предшествует изучение нитросоединений. Оно проводится преимущественно в плане обобщения, так как с отдельными представителями этого класса веществ учащиеся знакомились ранее. В связи с этим опыты для изучения нитробензола, пикриновой кислоты и других нитросоединений описаны в предыдущих главах и здесь не приводятся.
Опыты с алифатическими (жирными) аминами ниже даны сравнительно в небольшом количестве, так как эти соединения совершенно не рассматриваются в курсе химии или о них сообщаются лишь краткие сведения.
Красители, даже самые простейшие, обычно не изучаются в школе. Однако, учитывая большое образовательное значение знакомства с ними и высокий интерес учащихся к синтетической химии, ниже мы даем серию опытов для внеклассной работы
ЖИРНЫЕ АМИНЫ
Основная идея опытов с жирными аминами заключается в том чтобы представить амины как органические основания
В соответствии с этим наиболее важными Являются опыты окрашивания лакмуса водным раствором аминов; реакция солеобразования с кислотами; реакция выделения аминов из солей действием щелочей. Уяснение этих явлений позволит учащимся понять в дальнейшем свойства важнейшего представителя ароматических аминов — анилина.
Методическая сложность проведения опытов заключается в том, что начинать их приходится с получения аминов, чтобы иметь возможность далее демонстрировать их свойства Реакция же получения аминов действием щелочей на их соли не может быть понята учащимися до тех пор, пока они не познакомятся со свойствами этих соединений.
Поэтому при получении аминов на уроке тем или иным способом химизм образования их не рассматривают, а сразу переходят к изучению свойств. Возвращаются же к химизму лишь тогда, когда будет показано, что амины образуют с кислотами coли (например CH3NH2 + HCI à CH3NH3CI) и могут быть выделены из последних щелочами (CН3NH2•HCI + NaOH à СН3 NH + NaCI + Н2О)
Получение аминов из селедочного рассола. В селедочном рассоле содержится значительное количество аминов, преимущественно диметиламина (CH3)2NH и триметиламина (СН3)3N. Их присутствием и обусловливается характерный запах рассола
При отсутствии хлористоводородной соли метиламина вполне можно воспользоваться селедочным рассолом для практического ознакомления со свойствами жирных аминов
а) В большую круглодонную колбу с отводной трубкой наливают 15-20 мл селедочного рассола, добавляют 6-7 мл концентрированного раствора гидроксида натрия (раствор должен быть сильно щелочным), нагревают и отгоняют амины в пробирку с водой, охлаждаемую снегом или льдом. Через несколько минут образуется раствор, с которым можно проделать следующие опыты иллюстрирующие основные свойства аминов.
К части раствора приливают нейтральный раствор лакмуса или раствор фенолфталеина. Лакмус синеет, фенол-фталеин становится
малиновым. Делается вывод о том, что продукт соединения аминов с водой (рассматривать можно на примере метиламина) обладает щелочными свойствами, подобно раствору аммиака:
NН3 + НОН à NH4OH
CH3NH2 + НОН à CH3NH3OH
К части раствора приливают раствор хлорида железа (III). Параллельно ставят опыт взаимодействия хлорида железа (III) с раствором аммиака. Наблюдают образование одинаковых осадков, что подтверждает основные свойства водного раствора амина:
FeCI3 + 3NH4OH à Fe(OH)3 + 3NH4CI
FeCl3 + 3CH3NH3OH à Fe(OH)3 + 3CH3NH3CI
Кипятят в пробирке немного полученного раствора с добавкой щелочи и к выделяющимся парам подносят лучинку, смоченную концентрированной соляной кислотой. Образуется белый дым хлорида метиламмония (черный фон!).
Предыдущие опыты показывают большое сходство аминов с аммиаком. Для установления отличия их от аммиака и принадлежности к органическим соединениям демонстрируют горючесть аминов. Кипятят раствор амина и поджигают пары его у отверстия пробирки.
Последние два опыта получаются лишь в том случае, если, пользуясь селедочным рассолом, удается получить не слишком слабый раствор аминов.
б) Нагревают в колбе смесь селедочного рассола со щелочью, как было указано выше. К отводной трубке колбы подносят влажную лакмусовую бумажку, бумажка синеет. Подносят стеклянную палочку, смоченную концентрированной НСI, образуется белое облачко хлоридов аминов. Поджигают пары аминов у отводной трубки, они горят бледным пламенем. Пропускают пары в раствор хлорида железа (III), образуется осадок гидроксида железа (III).
Получение метиламина из хлористоводородной соли и опыты с ним. Предварительно учащиеся знакомятся с запахом метиламина. Для этого в пробирке или на стекле к небольшой щепотке хлорида метиламина они прибавляют 5—7 капель концентрированного раствора щелочи. Отмечают сходство запаха выделяющегося метиламина с запахом аммиака.
Для демонстрации опытов с метиламином в небольшую колбочку с отводной трубкой и капельной воронкой помещают 2—3 г соли, в капельную воронку наливают концентрированный раствор щелочи. Метиламин получают, прибавляя понемногу из воронки щелочь. С метиламином проделывают следующие опыты:
а) Пропускают выделяющийся газ в воду, подкрашенную фиолетовым или красным лакмусом. Лакмус синеет. Делают заключение о том, что не только по запаху метиламин имеет сходство с аммиаком, но и по химическим свойствам (щелочные свойства водного раствора). Составляется уравнение.
б) Получают снова раствор метиламина, пропуская газ в воду (без лакмуса), и проводят реакцию с раствором хлорного железа, как было указано выше. Подтверждаются щелочные свойства гидроксида метиламмония.
в) К отводной трубке колбы подносят открытую склянку с концентрированной соляной кислотой или палочку, смоченную кислотой. Образуется густое облако дыма хлористоводородной соли (черный фон!). Параллельно ставят опыт с аммиаком. Составляют уравнение реакции солеобразования и, проводя далее аналогию с аммиаком и солями аммония, объясняют реакцию получения амина из соли (см. выше).
г) Чтобы показать отличие метиламина от аммиака, демонстрируют горючесть метиламина, поджигая газ у отводной трубки колбы. Учащиеся знают, что аммиак на воздухе не горит. Для большей убедительности над пламенем горящего метиламина помещают стакан, сполоснутый известковой или баритовой водой. Появление мути на стенках свидетельствует о наличии углерода в горящем веществе (чего нет в аммиаке) и о принадлежности его к органическим соединениям.
Дата добавления: 2018-11-26; просмотров: 1361;











