Свойства и применение серной кислоты. Способы получения серной кислоты.
Серная кислота может существовать как самостоятельное химическое соединение H2SO4, а также в виде соединений с водой H2SO4*2H2O, H2SO4*H2O, H2SO4*4H2O и с триоксидом серы H2SO4*SO3, H2SO4*2SO3. В технике серной кислотой называют и безводную H2SO4 и ее водные растворы (по сути дела, это смесь H2O, SO2 и соединений H2SO4 *nH2O) и растворы триоксида серы в безводной H2SO4 – олеум (смесь H2SO4 и соединений H2SO4*nSO3). Безводная серная кислота – тяжелая маслянистая бесцветная жидкость, смешивающаяся с водой и триоксидом серы в любом соотношении. Физические свойства серной кислоты, такие, как плотность, температура кристаллизации, температура кипения, зависят от ее состава. Безводная 100%-ная кислота имеет сравнительно высокую температуру кристаллизации 10,7 *С. Чтобы уменьшить возможность замерзания товарного продукта при перевозке и хранении, концентрацию технической серной кислоты выбирают такой, чтобы она имела достаточно низкую температур кристаллизации. Промышленность выпускает три вида товарной серной кислоты.
Существуют 2 промышленных способа получения серной кислоты: контактный и нитрозный.
При контактном способе получения серной кислоты сульфидную руду (чаще всего железный колчедан FеS2) обжигают в специальных колчеданных печах. При этом получается обжиговый газ, содержащий приблизительно 9 % сернистого ангидрида.
Перед тем, как произвести окисление сернистого газа в серный ангидрид, обжиговый газ очищают от целого ряда примесей, которые могут затруднить и даже сделать невозможным последующее окисление. Одной из таких примесей является пыль, которая может отравить катализатор. Очистка от пыли производится в специальных устройствах - циклон-аппаратах и электрофильтрах.
В контактном аппарате производится окисление сернистого ангидрида в серный. Эта реакция является экзотермической. Однако образующийся серный ангидрид термически малоустойчив и при высокой температуре может снова разлагаться на кислород и сернистый газ. Таким образом реакция 2 SO2 + O2 →2 SO3 обратима.
При низкой температуре окисление идет очень медленно и значительная часть сернистого газа, проходя через контактный аппарат, не успевает окислиться. Поэтому, чтобы достигнуть максимальной степени окисления сернистого газа и в то же время избежать разложения серного ангидрида, скорость газа регулируют таким образом, чтобы температура в контактном аппарате поддерживалась в пределах 470-490 град. С.
При нитрозном способе получения серной кислоты окисление сернистого газа осуществляется оксидами азота. Обжиговый газ подается в продукционную башню 1, орошаемую нитрозилсерной кислотой (NОНSО3). Для запуска процесса сернистую кислоту окисляют азотной кислотой согласно уравнениям:
SО2 + Н2О = Н2SО3;
3 Н2SO3 + 2 НNО3 = 3 Н2SО4 + 2 NО + Н2О.
Оксиды азота вместе с выхлопными газами (азот и кислород) подаются в башню 2 для окисления монооксида азота в диоксид. Поток газа регулируют таким образом, чтобы 50 % газа проходило через окислительную башню, а 50 % - миновало ее. Таким образом в поглотительную башню попадает газовая смесь, содержащая монооксид и диоксид азота в эквимолярном соотношении, вследствие чего образуется азотистый ангидрид:
NО + NО2 = N2О3.
При низкой температуре равновесие сдвигается в сторону образования азотистого ангидрида (N2О3), а при повышении температуры - в сторону образования монооксида и диоксида азота. В поглотительной башне азотистый ангидрид реагирует с концентрированной серной кислотой, образуя нитрозилсерную кислоту:
N2О3 + 2 Н2SO4 = 2 NОНSО4 + Н2О.
Эта реакция может протекать только с концентрированной серной кислотой. При разбавлении водой нитрозилсерная кислота вновь разлагается на серную кислоту и оксиды азота.
Нитрозилсерная кислота подается на орошение в продукционную башню, где и разлагается водой, а выделившийся азотистый ангидрид окисляет образующуюся в башне сернистую кислоту:
2 NОНSO4 + Н2О = 2 Н2SO4 + N2О3;
SO2 + Н2О = Н2SO3;
Н2SО3 + N2О3 = Н2SO4 + 2 NО.
Монооксид азота вновь направляется в окислительную башню и процесс повторяется.
Оксиды азота, которые не поглотились серной кислотой, улавливаются в санитарной башне (на схеме не показана), в которую подают либо раствор соды (Nа2СО3), либо раствор извести (Са(ОН)2):
N2О3 + Nа2СО3 = 2 NаNО2 + СО2;
2 NО2 + Nа2СО3 = NаNО3 + NаNО2 + СО2;
N2О3 + Са(ОН)2 = Са(NО3)2 + Н2О;
4 NО2 + 2 Са(ОН)2 = Са(NО3)2 + Са(NО2)2 + 2 Н2О.
Потеря оксидов азота компенсируется введением новых порций азотной кислоты.
Концентрация серной кислоты, получаемой нитрозным способом, достигает 70-80 %.
Серная кислота находит самое широкое применение. Она используется для получения соляной, азотной, фосфорной, плавиковой и многих органических кислот методом обмена, в производстве фосфорных и азотных удобрений, органических сульфосоединений, для очистки различных газов, входит в состав нитрующих смесей, используется в производстве красителей, для зарядки аккумуляторов и др.
Широко применяются соли серной кислоты. Сульфат натрия (глауберова соль Nа2SO4 * 10Н2О) применяется для производства соды и в стекольной промышленности. Сульфат кальция распространен в природе в виде двуводного кристаллогидрата гипса (СаSO4 * 2Н2О) и безводной соли ангидрита (СаSO4).
Ангидритовые вяжущие материалы получают путем обжига гипсового камня при повышенных температурах (600-700 град. С) с различными добавками. При этом получают отделочный гипсовый цемент и кальцинированный гипс (экстрих-гипс).
Эти материалы затвердевают значительно медленнее, чем полуводный гипс, и применяются для изготовления строительных растворов и бетонов малой прочности, а также искусственного мрамора, бесшовных настилов полов и др.
Сульфат магния, или горькая соль (МgSO4 * 7Н2О) применяется в медицине как слабительное.
Сульфат железа (II), или железный купорос (FеSO4 * 7Н2О) применяется для приготовления желтой кровяной соли (К4[Fе(СN)6]), чернил, для очистки воды и консервирования дерева.
Сульфат меди, или медный купорос (СuSО4 * 5Н2О) применяется для борьбы с различными грибками - вредителями сельского хозяйства, для производства медных покрытий и получения различных соединений меди.
Из растворов, содержащих сульфат трехвалентного металла (Fе3+, Аl3+, Сг3+) и сульфат одновалентного металла (К+, NН4+, Rb+), выкристаллизовываются двойные соли типа К2SO4 * Al2(SO4)3 * 24H2O или КАl(SO4)3 * 12Н2О. Вместо калия и алюминия могут стоять в любом сочетании перечисленные элементы.
Эти соединения называются квасцами. Квасцы существуют только в твердом виде. В растворе они ведут себя как 2 самостоятельные соли, т. е. как смесь сульфатов одно- и трехвалентных металлов.
30. Принципиальная технологическая схема получения серной кислоты из серы.
Технологический процесс производства серной кислоты из элементарной серы контактным способом отличается от процесса производства из колчедана рядом особенностей. К ним относятся:
– особая конструкция печей для получения печного газа;
– повышенное содержание оксида серы (IV) в печном газе;
– отсутствие стадии предварительной очистки печного газа.
Последующие операции контактирования оксида серы (IV) по физико-химическим основам и аппаратурному оформлению не отличаются от таковых для процесса на основе колчедана и оформляются обычно по схеме ДКДА. Термостатирование газа в контактном аппарате в этом методе осуществляется обычно путем ввода холодного воздуха между слоями катализатора.
Принципиальная схема производства серной кислоты из серы представлена на рис. 1:
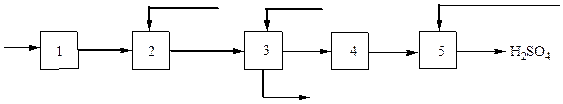
Рис. 1. Структурная схема производства серной кислоты из серы.
1 – осушка воздуха; 2 – сжигание серы; 3 – охлаждение газа, 4 –контактирование; 5 –абсорбция оксида серы (IV) и образование серной кислоты.
Дата добавления: 2016-10-26; просмотров: 4335;











