Диеновые углеводороды
Углеводороды
Благодаря способности атомов углерода образовывать цепи и циклы различного размера и формы, а также различные типы связей возможно существование большого числа углеводородов. Углеводороды разных типов отличаются друг от друга также степенью насыщения водородом. Число атомов водорода в молекуле любого углеводорода чётное.
Алканы
Алканы являются углеводородами, наиболее богатыми водородом, они насыщены им до предела. Отсюда названия - насыщенные или предельные углеводороды. Их называют также парафинами или углеводородами ряда метана (по первому члену ряда).
Гомологический ряд. Каждый последующий член ряда отличается от предыдущего по составу на одну группу CH2. Общая формула ряда СnН2n+2. Простейший представитель CH4 - метан. Химические свойства всех парафинов сходны. Отсюда ряд соединений, обладающих сходным химическим строением, сходными свойствами и отличающихся друг от друга по составу на группу CH2, называется гомологическим рядом. Члены этого ряда носят название гомологов, разница в составе двух соседних членов ряда называется гомологической разницей.
Строение. Общая черта в строении насыщенных соединений простая или одинарная связь между атомами углерода. На образование этой связи затрачивается одна пара электронов.
Изомерия. Вид изомерии, когда вещества отличаются порядком связи атомов в молекуле, называют структурной изомерией. Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии - изомерией углеродного скелета(рис. 2). Соединения, имеющие неразветвленную углеродную цепь, называют нормальными.
Метан, этан, пропан существуют только в одной форме, не имеют изомерии.
C4 H10 бутан:
CH3-CH2-CH2-CH3 н-бутан; CH3-CH-CH3 изобутан.

CH3
C5H12 пентан:
 CH3-CH2-CH2-CH2–CH3 н-пентан; CH3-CH-CH2-CH3
CH3-CH2-CH2-CH2–CH3 н-пентан; CH3-CH-CH2-CH3
изопентан;
CH3
CH3

CH3-C-CH3 неопентан

CH3
Рис. 2. Изомерия алканов
С увеличением числа атомов углерода в молекуле возрастает и число теоретически возможных изомеров. Для углеводородов с C1…C3они получены, для высших членов ряда известны лишь некоторые.
Если атом углерода затрачивает на углерод-углеродную связь одну единицу валентности, то его называют первичным, две - вторичным, три - третичным, все четыре - четвертичным. У нормальных алканов бывают только первичные (на концах) и вторичные (в середине) атомы углерода.
Одновалентные остатки, получающиеся при отнятии атома водорода от алканов, называют алкилами, например, CH3 - метил, C2H5- этил и т.д. Общая формула алкилов Cn H2n+1, их часто заменяют сокращенно Alkили R. Алкилы могут быть первичными, вторичными или третичными(рис. 3).
Физические свойства. Первые четыре члена гомогологического ряда - газообразные вещества, от C5 до C15 - жидкости, от C16 и выше - твёрдые вещества. В гомогологическом ряду постепенно увеличиваются температура кипения, плавления и плотность, например: метан CH4 Tпл =-182,50 С; Ткип =-161,50 С; относит. плот.= 0,424. Гептан C7 H16Тпл =-90,60 С; Ткип .= +98,40 С; относит. плот.= 0,684.
CH3-CH2-CH2-CH2- CH3-CH2-CH-CH3

Бутил CH
вторичный бутил
(втор-бутил)
CH3 CH3
 |  |
CH3-CH-CH2- CH3-C-CH3
 |
изобутил третичный бутил
(трет-бутил)
Рис. 3. Примеры алкилов
Алканы с разветвленной цепью кипят при более низкой температуре, чем изомеры с нормальной цепью. Температура плавления, наоборот, повышается с ростом разветвленности углеродной цепи. Плотности всех алканов меньше «1», они все нерастворимы в воде, однако растворимы в эфирах и др. органических растворителях. Углеводороды C3…C15имеют запах бензина или керосина, первые два члена почти не пахнут, высшие не пахнут из-за плохой летучести.
Химические свойства. В химическом отношении алканы мало активны, из-за этого и названы парафинами. При обычных температурах на них не действуют концентрированные кислоты (азотная, серная и т.д.), расплавленные и концентрированные щёлочи, обычные окислители (перманганат калия, хромовая смесь). Металлы не вытесняют водород из их соединений.
Всё это определяет круг реакций насыщенных углеводородов:
- радикальные реакции замещения, идущие в жёстких условиях (свет, высокая температура и т.д.);
- к реакции присоединения алканы неспособны, чем и отличаются от непредельных углеводородов:
- при крекинге (t = 400...6000 C) происходит расщепление высококипящих углеводородов на молекулы простых низкокипящих. Предельные углеводороды образуют простые насыщенные и ненасыщенные (рис. 4).
- при пиролизе (t = 650...7000 С) идёт более глубокий распад и образуется много водорода, кокса и простейших предельных и непредельных углеводородов;
 CH3-CH2-CH2–CH3 CH3-CH3 + CH2=CH2
CH3-CH2-CH2–CH3 CH3-CH3 + CH2=CH2
бутан этан этилен
Рис. 4. Расщепления предельного углеводорода при крекинге
- дегидрирование - отнятие водорода с превращением предельных углеводородов в непредельные;
- ароматизация превращение в ароматические углеводороды;
- изомеризация перестройка углеродного скелета.
Циклоалканы
Циклическими называют соединения, имеющие замкнутые цепи (от греч. «циклос» - круг). Молекулы незамещенных циклоалканов (циклопарафинов) состоят из замкнутых в цикл групп CH2; по названию этой группы их иногда называют полиметиленовыми углеводородами.
Строение, номенклатура, изомерия. Общая формула гомологического ряда циклоалканов (CH2)n или CnH2n. Таким образом, молекула циклоалкана содержит на два атома водорода меньше, чем парафин с тем же числом атомов углерода. Название циклоалканов образуют путём добавления приставки цикло к названию соответствующего алкана (рис. 5).
Изомерия C5H10
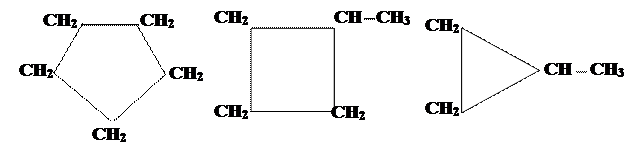
циклопентан метилциклобутан этилциклопропан
Рис. 5. Примеры циклоалканов
В нефти циклоалканы называют нафтенами.
Физические свойства. Первые два члена этого ряда (циклопропан C3H6, циклобутан C4H8) - газы, C5…C10 - жидкости, высшие твёрдые вещества. Температура кипения и плавления циклоалканов, как и их плотности, несколько выше, чем у парафинов с равным числом атомов углерода. Как и парафины, циклоалканы практически нерастворимы в воде.
Химические свойства. По химическому характеру малые циклоалканы склонны к реакциям присоединения, в результате которых происходит разрыв цикла и образуются парафины и их производные, чем они напоминают ненасыщенные соединения. Циклы с большим числом звеньев более склонны к реакциям замещения, напоминая этим парафины.
Например, циклопентан используется как добавка к моторному топливу для повешения его качества.
Алкены
Алкенами называют ненасыщенные углеводороды, содержащие в молекуле оду двойную связь (рис.6). Часто их называют олефины. Простейший представитель этилен C2H4. Гомологический ряд этиленовых углеводородов имеет общую формулу CnH2n, т.е. такую же, как и циклопарафины. Таким образом, олефины и циклопарафины - изомеры, относящиеся к различным гомологическим рядам.
Строение алкенов. Характерной особенностью строения является наличие в молекуле одной двойной углерод-углеродной связи.
CH2 = CH2
Рис. 6. Этилен
Для олефинов характерна изомерия углеродного скелета и изомерия положения двойной связи. Названия олефинов характеризуются окончанием илен: этилен, пропилен, бутилен и т.д.
Физические свойства. Олефины по физическим свойствам близки к соответствующим парафинам. Однако температура кипения их несколько ниже, чем у соответствующих парафинов, а плотность несколько выше. Первые три члена ряда С2…С4 - газы, от С5до С17 - жидкости, С18 и выше – твёрдые вещества. Изомерия углеродной цепи, изомерия положения двойной связи отражаются на физических константах изомеров (т.е. температурах кипения, плавления, плотности). Все олефины имеют плотность меньше единицы, обладают характерным запахом, в воде растворимы плохо, но все же много лучше, чем соответствующие парафины.
Химические свойства. Для олефинов характерны реакции присоединения с разрывом двойной связи. Кроме того, олефины могут вступать в реакцию между собой (реакция полимеризации), легко подвергаются действию различных окислителей, вступают в реакцию с озоном и в некоторых случаях могут вступать в реакцию замещения.
Алкины
Алкины - ненасыщенные углеводороды, содержащие в молекуле одну тройную связь (рис. 7). Простейшим представителем алкинов является ацетилен C2H2, поэтому их часто называют ацетиленовыми углеводородами. Общая формула алкинов Cn H2n-2.
Строение, изомерия, номенклатура. Главный фактор, характеризующий сущность алкинов это тройная углерод-углеродная связь.
CH º CH
Рис. 7. Ацетилен
Изомерия алкинов обусловлена строением углеродной цепи и положением тройной связи. Принцип построения названий тот же, что и алкенов. Названия алкинов имеют окончание ин: например, бутин.
Наиболее часто встречающиеся радикалы алкинов: CH=C- - этинил,
CH ºC-CH- - пропагил.
Физические свойства. По физическим свойствам алкины напоминают олефины и парафины. С2…С4 - газы, С5...С16 - жидкости, высшие - твёрдые вещества. Температура кипения и плотность алкинов несколько выше, чем у соответствующих алкенов. Растворимость низших алкинов в воде несколько выше, чем алкенов и алканов, однако всё же очень мала.
Химические свойства. Типичными реакциями как для ненасыщенных углеводородов являются реакции присоединения. Алкины легко окисляются с разрывом по тройной связи и в присутствии катализатора могут реагировать друг с другом (реакция полимеризации).
Диеновые углеводороды
Соединения, содержащие в углеродной цепи две двойные связи, называют диеновыми. Углероды такого типа с открытой цепью называют алкадиенами, а циклические - циклоалкадиенами.
Изомерия, номенклатура, классификация. Общая формула алкадиенов
CnH2n-2 (как и ацетиленов). Следовательно, соединения с двумя двойными связями изомерны соединениям с одной тройной связью.
Изомерия диеновых соединений обусловлена строением углеродного скелета и относительным расположением двойных связей. Перед окончанием ен, символизирующим двойную связь, ставят греческое числительное ди - так образуется окончание диен, например, бутадиен.
По взаимному расположению двойных связей диены различают:
§ C=C=C с кумулированными двойными связями; CH2=C=CH2 - аллен;
§ C=C-C=Cс сопряжёнными двойными связями; CH2=CH-CH=CH2- дивинил;
§ C=C-(Cn)-C=Cс изолированными двойными связями; CH2=CH-CH2-CH=CH2 - пентадиен 1,4.
Химические свойства. Реакции присоединения типичны как для всех ненасыщенных углеводородов, но особенностью их является возможное получение двух продуктов, так как разрывается только одна двойная связь, вторая остается незатронутой.
Дата добавления: 2021-01-26; просмотров: 611;











