ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА ГАЗОВ
7.1. Газообразные рабочие тела. Некоторые рабочие тела, такие как водяной пар, аммиак, фреоны, осуществляя взаимопревращения “теплоприток-работа” в теплосиловых (паротурбинных) и холодильных (аммиачных, фреоновых) машинах, многократно повторяют процессы парообразования и конденсации, циркулируя по контуру машины. В других машинах - дизелях, карбюраторных двигателях, газотурбинных установках, воздушных холодильных машинах - процессы парообразования и конденсации отсутствуют или проявляются только в сопутствующих, не основных процессах. Рабочими телами в таких машинах являются воздух и газовые смеси - продукты сгорания топлива.
Область состояний реальных газов, в которой они приобретают
Свойства идеальных газов
Термодинамические свойства газов, то есть соотношение между их параметрами и функциями в равновесном состоянии зависят в общем случае от уровня температур и давлений. При не слишком высоких давлениях их плотности малы (удельные объемы велики), поэтому их термодинамические свойства приближаются к свойствам идеальных газов.
Термическое уравнение состояния идеальных газов -
Формула Клапейрона-Менделеева
Термодинамические свойства идеальных газов определяются по достаточно простым формулам, называемым уравнениями состояния. Первым уравнением состояния является известное уравнение Клапейрона-Менделеева (для газа массой 1 кг):
pv = RT, (1-16)
где газовая постоянная R, кДж/(кг.К), данного газа определяется по универсальной газовой постоянной Rм = 8,31441 кДж/(кмоль.К) и молярной массе данного газа M, кг/кмоль:
R = Rм / M. (1-17)
Например, для воздуха (М = 29 кг/кмоль) R=8,314 / 29 = 0,287кДж/кг/К. Значения газовой постоянной R разных газов приводятся во многих таблицах.
Закон Джоуля
Вторая отличительная особенность идеальных газов - это то, что их энтальпия и внутренняя энергия зависят только от температуры (закон Джоуля). Так, если в общем случае удельная энтальпия определяется как функция двух параметров, h = h(t, p), то согласно закону Джоуля в случае идеального газа энтальпия не зависит от изменения давления:
hид= h(t), uид= u(t). (1-18)
7.5. Теплоемкости сР и сV газов
Важной характеристикой термодинамических свойств веществ, особенно газов, является их т е п л о е м к о с т ь. Теплоемкостью называют способность тел воспринимать определенную величину теплопритока при изменении температуры тела на один градус.
Теплоемкость единицы массы тела (1 кг) обозначают буквой с и измеряют в кДж/кг/К, или, что равносильно, в кДж/кг / оС.
Различают теплоемкости - среднюю в интервале температур t1...t2
и истинную в окрестностях температуры t:
c12 = q / (t2- t1), сt = dq / dt. (1-19)
Эти теплоемкости связаны очевидным соотношением
с12(t2- t1) = 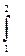 ct dt .
ct dt .
Особенностью, отличающей газы от твердых или жидких тел, является способность газов при изменении температуры существенно изменять объем. Поэтому величина теплоемкости зависит от вида процесса. Важную роль в расчетах играют теплоемкости изобарного и изохорного процессов.
Чтобы различать теплоемкости этих двух процессов - изобарного и изохорного, их обозначают различными нижними индексами: cP и cV.
Можно показать, что теплоемкости ср и сv с связаны с энтальпией и соответственно внутренней энергией газов. Действительно, первый закон термодинамики для равновесных процессов выражается любым из двух равенств -
dq = dh - v dp, или dq = du + p dv. (1-20)
При p = const первое из этих равенств принимает вид
dqp= dh, или qp= h2- h1 ,
откуда с учетом формулы (1-19) выявляется прямая взаимозависимость между энтальпией и изобарной теплоемкостью:
dh = cp dt, (1-21)
h2- h1= (cp)12 (t2 - t1). (1-22)
Аналогично, при v = const имеем
dqv= du, qv = u2 - u1
du = cvdt,
u2 - u1 = (cv)12 (t2 - t1). (1-23)
Полученные равенства, действительно, устанавливают взаимозависимость между изменением ср и h и между изменением сv и u.
Дата добавления: 2016-10-18; просмотров: 3599;











