МЕЖМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ
Водородная связь
Водородная связь – это связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы или между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом той же молекулы (внутримолекулярная водородная связь).
Водородная связь возникает между электроотрицательным элементом
(F, O, N, S, Cl) и атомом водорода.
Водородная связь имеет частично электростатический и частично донорно-акцепторный механизм возникновения.
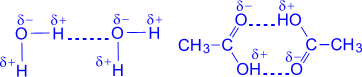 а) б)
а) б)
|
Рис. 4.10. Примеры водородных связей в Н2О (а) и уксусной кислоте (б)
Наличием водородных связей обусловлены уникальные свойства многих веществ, в том числе и воды. Трехатомная молекула Н2О образует четыре
водородные связи. В их образовании принимают участие оба атома водорода и атом кислорода, имеющий две неподеленные электронные пары, которые образуют две водородные связи с атомами водорода соседних молекул воды.
Водородные связи являются причиной и другого уникального свойства воды – плотность льда меньше плотности воды. В структуре льда каждый атом кислорода связан через атомы водорода с четырьмя другими атомами кислорода – из других молекул воды. В результате образуется очень рыхлая «ажурная» структура. Вот почему лед такой легкий.
При плавлении льда (0оС) около 10% водородных связей разрушается, и молекулы воды немного сближаются. Поэтому плотность жидкой воды при температуре плавления выше, чем плотность льда. Дальнейшее нагревание за счет увеличения амплитуды колебания молекул вызывает увеличение объема воды. Это происходит со всеми веществами.
Наличие водородных связей влияет и на кислотные свойства многих веществ. Так фтороводородная кислота, в отличие от других галогеноводородных кислот, является слабой, так как атомы водорода связаны сразу с двумя атомами фтора, что и препятствует отщеплению протона. Благодаря особо прочным водородным связям фтороводородная кислота – единственная одноосновная кислота, способная образовывать кислые соли, например, NaHF2.
В газовой фазе HF существует в виде димера.
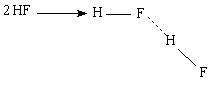
Наличие водородных связей объясняет высокие температуры кипения воды, спиртов и карбоновых кислот. Водородная связь увеличивает вязкость растворов, температуры кипения и плавления веществ. Энергия водородной связи находится в диапазоне 8-40 кДж/моль, что меньше энергии обычной ковалентной связи (150-400 кДж/моль).
Межмолекулярное взаимодействие – взаимодействие молекул между собой, не приводящее к разрыву или образованию новых химических связей. На расстояниях ~10-9 м между соседними молекулами возникают заметные силы притяжения, называемые Ван-дер-Ваальсовыми силами. Эти силы имеют электрическую природу и включают в себя три составляющие (ориентационную, индукционную и дисперсионную), которые определяют отличие реальных газов от идеальных, существование жидкостей и молекулярных кристаллов. От них зависят многие структурные, спектральные и другие свойства веществ.
Ориентационное взаимодействие.Полярные молекулы, в которых центры тяжести положительного и отрицательного зарядов не совпадают, например, HCl, H2O, NH3, ориентируются таким образом, чтобы рядом находились концы с противоположными зарядами. Между ними возникает притяжение:

Притяжение диполь-диполь может осуществляться только тогда, когда энергия притяжения превышает тепловую энергию молекул, что обычно имеет место в твердых и жидких веществах. Диполь-дипольное взаимодействие проявляется также в полярных жидкостях (вода, фтороводород и в ряде других).
Индукционное взаимодействие.Если полярная молекула окажется рядом с неполярными молекулами, то она начнет влиять на них. Поляризация нейтральной частицы под действием внешнего поля (наведение диполя) происходит благодаря наличию у молекул свойства поляризуемости γ. Поляризуемость – это способность вещества или молекулы образовывать диполь при наложении электрического поля. Постоянный диполь, или заряженная частица, может индуцировать дипольное распределение зарядов в неполярной молекуле.
Под действием заряженных концов полярной молекулы электронные облака неполярных молекул смещаются в сторону положительного заряда и подальше от отрицательного. Неполярная молекула становится полярной, и молекулы начинают
притягиваться друг к другу, только намного слабее, чем две полярные молекулы:
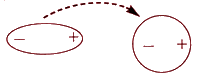
Этот вид взаимодействия проявляется, главным образом, в растворах полярных соединений в неполярных растворителях.
Дисперсионное взаимодействие.Между неполярными молекулами также может возникнуть притяжение. Электроны, которые находятся в постоянном движении, на миг могут оказаться сосредоточенными с одной стороны молекулы, то есть неполярная частица на мгновение станет полярной. Это вызывает перераспределение зарядов в соседних молекулах, и между ними устанавливаются кратковременные связи:

Силы притяжения между неполярными частицами (атомами, молекулами) являются короткодействующими. Эти связи очень слабые – самые слабые из всех межмолекулярных взаимодействий.
Дисперсионное взаимодействие универсально, оно присуще всем молекулам и чем больше поляризуемость молекул, тем сильнее дисперсионное взаимодействие.
Энергия дисперсионного взаимодействия невелика (0,8-8,0 кДж/моль), примерно в 100 раз меньше энергии химической связи.
Межмолекулярное отталкивание.Если бы молекулы только притягивались друг к другу, это привело бы к их слиянию. Но на очень малых расстояниях их электронные оболочки начинают отталкиваться.
Таким образом, межмолекулярное взаимодействие присутствует всегда и обусловлено действием ориентационных, индукционных и дисперсионных сил,
которые увеличивают температуры кипения и плавления веществ, напряжения сдвига и т.д. Наличие этих сил приводит к образованию целого ряда непрочных и устойчивых лишь при низких температурах соединений, в образовании которых могут участвовать и молекулы инертных газов: HgHe, WНе2, Ar(H2O)6 и т.д.
Дата добавления: 2021-01-26; просмотров: 518;











