МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
Полное название метода – метод молекулярных орбиталей (МО) как линейная комбинация атомных орбиталей (ЛКАО). Метод МО ЛКАО рассматривает молекулу как единую систему, как единый коллектив взаимодействующих частиц с ядрами и электронами, которые и образуют молекулярные орбитали (МО).
Основу метода МО составляют следующие положения.
1.Молекулярные орбитали образуются путем линейной комбинации атомных орбиталей всех атомов в молекуле. Общее число образующихся МО равно числу взаимодействующих АО, т.е. из n взаимодействующих атомных орбиталей образуется n молекулярных орбиталей.
2. Каждый электрон в молекуле находится на определенном энергетическом уровне, характеризующемся соответствующими квантовыми числами.
3. Энергетическому уровню отвечает МО или волновая функция, которая является полиядерной.
Молекулярная волновая функция имеет тот же физический смысл, что и атомная, т.е. Y2 определяет плотность вероятности пребывания электронов в данной точке пространства. Заполнение электронами энергетических уровней в молекуле также происходит по принципу минимума энергии, принципу Паули, согласно которому на одной орбитали может находиться не более двух электронов, и правилу Хунда.
Если волновую функцию изолированного атома А обозначить через Yа, а волновую функцию изолированного атома В - Yв, то, согласно методу ЛКАО, волновая функция молекулы представляет линейную комбинацию атомных волновых функций:
Yав = С1Yа ± С2Yв, (4.2)
где Сi – коэффициенты, учитывающие долю участия атомных орбиталей атомов А и В в образовании МО.
Сложение двух АО означает, что два электрона охватывают оба ядра. Такая МО является двухцентровой.
Сложение Yав = С1Yа + С2Yв означает, что оба электрона проводят большую часть времени между двумя ядрами, где реализуется наибольшая электронная плотность, что и способствует связыванию атомов. Такую МО называют связывающей и обозначают (ss), (sр) и т.д. Заселение связывающей МО электронами приводит к понижению энергии молекулы и повышению ее устойчивости.
При вычитании функций Yав = С1Yа – С2Yв электронная плотность направлена в разные стороны от атомов, концентрируется за ядрами, а между ядрами она мала и практически равна нулю. Такое расположение электронной плотности растягивает межатомную связь, делая ее непрочной. Такую орбиталь называют разрыхляющей и обозначают (s*s), (s*р).
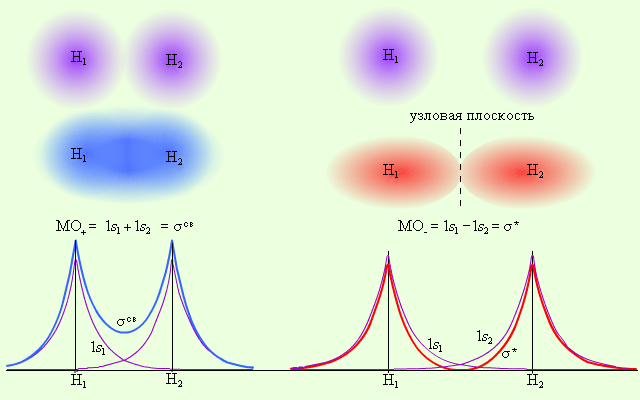
Заселение разрыхляющих или антисвязывающих орбиталей электронами приводит к повышению энергии молекулы и понижению ее устойчивости в целом. Поскольку в молекуле водорода взаимодействие возможно только по оси молекулы, то каждая из MO± может быть обозначена как σсв = 1s1 + 1s2 и σ* = =1s1 – 1s2 и названа соответственно связывающей (σсв) и разрыхляющей (σ*) молекулярными орбиталями (рис. 4.6).
|
Рис. 4.6. Распределение электронной плотности в молекуле H2
Из рис. 4.6 видно, что электронная плотность посередине между ядрами для σсв значительна, а для σ* равна нулю. Отрицательно заряженное электронное облако, сконцентрированное в межъядерном пространстве, притягивает положительно заряженные ядра и соответствует связывающей молекулярной орбитали σсв. А МО с нулевой плотностью в межъядерном пространстве соответствует разрыхляющей орбитали σ*. Состояния σсв и σ* отвечают разным уровням энергии, причем молекулярная орбиталь σсв имеет более низкую энергию по сравнению с исходными АО двух невзаимодействующих атомов водорода 1s1 и 1s2 (рис. 4.7).
Е МО σразр(1s-1s)
АО 1s АО 1s
МО σсвяз(1s+1s)
Рис. 4.7. Энергетическая диаграмма атомных и молекулярных уровней водорода
Заселение электронами связывающей МО σs стабилизирует систему, а заселение разрыхляющих – дестабилизирует ее. Таким образом, переход двух электронов на МО σсв молекулы водорода способствует понижению энергии системы; этот энергетический выигрыш равен энергии связи между атомами в молекуле водорода H – H.
Аналогичным образом можно рассмотреть возможность образования частиц Н2+, Не2+ и невозможность существования молекулы Не2.
Е,кДж АО МО АО АО МО АО АО МО АО
σ* σ* σ*
а) б)
Н0 Н+ Не+ Не0 Не0 Не0
σсв σсв σсв
а) H2+ б) He2+в) Не2 (не существует)
Рис. 4.8. Энергетические диаграммы образования МО Н2+, Не2+, Не2
Порядок связи.В методе МО понятие валентности как таковой теряется, поскольку даже спаренные электроны различных уровней заселяют те или иные МО. Вместо понятия валентности или кратности связи, в методе вводится новое понятие – порядок связи.
Порядок связи определяется как разность числа связывающих электронов и числа разрыхляющих электронов, деленная на два. В методе МО порядок связи играет такую же роль, что и валентность в методе ВС:
ПС = (∑(е)связ - ∑(е)раз)/2. (4.3)
Если ПС = О, то система неустойчива и связь не возникает, так как для образования соединения всегда необходимо, чтобы заселенность связывающих МО была выше, чем заселенность разрыхляющих. Образование системы энергетически выгодно и она устойчива, если ПС > О (например, для Н2+ ПС = 0,5).
Таблица 4.3
Дата добавления: 2021-01-26; просмотров: 574;











