Взаимосвязь кратности, длины и энергии связи С - С, С - О и N - N
| Связь | Длина (Ao ) | Е кДж/м | Связь | Длина (Ao ) | Связь | Длина (Ao) |
| С−С | 1,54 | С−О | 1,43 | N – N | 1,47 | |
| С=С | 1,33 | С=О | 1,23 | N = N | 1,24 | |
| С≡С | 1,31 | С≡O | 1,13 | N º N | 1,10 |
Одинарная связь всегда является σ-связью, в двойных связях - одна σ-связь и одна π-связь, в тройной связи – одна σ-связь и две π-связи.
σ-связи, образуемые S-электронами, являются неориентированными в пространстве, тогда как σ-связи, образованные с участием р-электронов, должны располагаться под углом 900 (рх, ру, рz). Опыты показывают, что в молекулахPH3, AsH3, SbH3 центральные атомы имеют по 3 неспаренных р-электрона. Связи между центральными атомами и атомами водорода абсолютно равноценны и расположены в пространстве под углами 90-930.
Большое число атомов образует связи с участием электронов разных подуровней. Например, у бериллия, бора и углерода в образовании связей участвуют s- и p-электроны второго уровня. Энергия σ-связей, образованных электронами разных подуровней, должна различаться. Однако экспериментально доказано, что в таких молекулах, как BeCl2, BF3, CH4, все связи абсолютно равноценны по энергии и молекулы являются абсолютно симметричными.
Теоретическое обоснование этих фактов было предложено Слейтером и Поллингом в виде теории гибридизации атомных орбиталей центрального атома в молекуле.
В нормальном состоянии атом углерода имеет следующую электронную структуру:
С
2s 2p
В данном состоянии атом углерода за счет имеющихся двух неспаренных электронов может образовать две ковалентные связи (одну σ- и однуπ-связь). Однако для углерода более характерны соединения, в которых каждый его атом связан с соседними четырьмя ковалентными связями (СО2, СН4, С2Н6 и т.д.). Это оказывается возможным благодаря тому, что при затрате небольшого количества энергии один из имеющихся спаренных s-электронов переходит на 2р-подуровень, а атом переходит в возбужденное состояние, и при этом число неспаренных электронов возрастает до четырех.
С С*
2s 2p
У возбужденного атома в момент образования химической связи под действием поля соседних атомов происходит перестройка валентных орбиталей, в результате которой они становятся равными по энергии (вырожденными) и по форме. Процесс смешивания и вырождения атомных орбиталей называется гибридизацией, для него характерно образование «равноценных» или вырожденных орбиталей, которые имеют форму сильно вытянутой в одну сторону восьмерки и
усредненную энергию. Процесс гибридизации требует затрат энергии, однако эти затраты перекрываются энергией, которая выделяется при образовании более прочных связей.
В процессе гибридизации могут принимать участие не только одноэлектронные орбитали, но и орбитали с несвязывающими электронными парами. Гибридные орбитали несут на себе одноименные заряды и отталкиваются друг от друга на возможно большее расстояние.
Существуют три основные предпосылки для процесса гибридизации.
1. Химические связи образуются электронами, находящимися на разных подуровнях, не сильно отличающихся по энергии.
2. Валентные орбитали должны обладать достаточной электронной плотностью, т.е. иметь небольшой радиус.
3. Возможность достаточно большой степени перекрывания гибридных орбиталей с орбиталями переферийных атомов.
В зависимости от того, орбитали каких подуровней подвергаются гибридизации, различают несколько типов этого явления и соответственно различные пространственные формы молекул.
sp-Гибридизация. Этот вид гибридизации характерен для элементов IIA группы периодической системы Ве, Мg, Ca и Ba, имеющих электронную конфигурацию ns2.
Ве
2s 2p
Для участия в образовании химических связей по обменному механизму атом Ве должен перейти в возбужденное состояние:
Ве*
Одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые «гибридные» орбитали, угол между осями которых равен 180°:
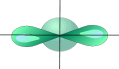
| ¾® | 
|
Две sp-орбитали могут образовывать две s-связи (BeH2, ZnCl2). Молекула гидрида бериллия выглядит следующим образом:
Ве
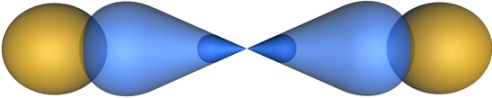
|
H H
Молекулы, в которых осуществляется sp-гибридизация, имеют линейную геометрию.
sp2 -Гибридизация. Данный вид гибридизации характерен для атомов В и А1 (ns2 nр1). Три sp2-орбитали могут образовывать три σ-связи (BF3, AlCl3). Примером молекулы, в которой осуществляется этот вид гибридизации, может служить молекула фторида бора ВF3:
В
2s 2p
В*
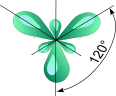
Схема возникновения гибридных орбиталей в этом случае выглядит следующим образом.Одна s-орбиталь и две p-орбитали превращаются в три одинаковые sp2 «гибридные» орбитали, угол между осями которых равен 120°:
p
s 
| ––® | 
|
Молекулы, в которых осуществляется sp2-гибридизация, имеют плоскую геометрию. На схеме далее приведена модель и геометрия молекулы ВС13:
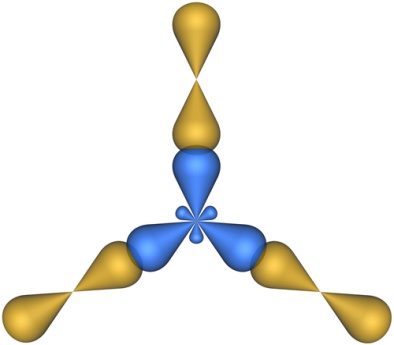
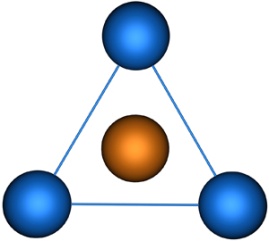
sp3-Гибридизация. В случае углерода и образования четырех σ-связей имеем так называемую sp3-гибридизацию (1 – s и 3 – р электрона; см. схему выше). Одна s-орбиталь и три p-орбитали превращаются в четыре одинаковые «гибридные» sp3-орбитали, угол между осями которых равен 109°28':
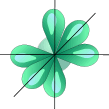
| ––® | 
|
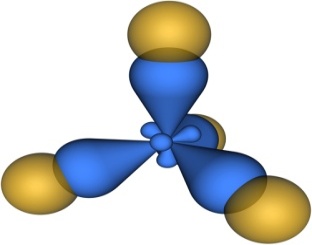
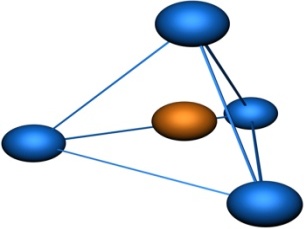
Молекулы, в которых осуществляется sp3-гибридизация, имеют тетраэдрическую геометрию (CH4, CС14):
| 
|
Гибридизация осуществляется только по σ-связям, а π-связи в гибридизации не участвуют. Например, в этилене тип гибридизации для углерода sp2.
Н Н
С = С
Н Н
Н
Н
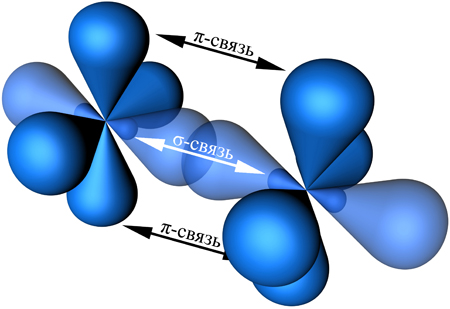 Н Н
|
Н
Рис. 4.4. Схема перекрывания АО в молекуле этилена
Из рис. 4.4 видно, что между С - С образуется одна гибридная σ-связь и одна не участвующая в гибридизации p-связь. Две орбитали pz различных атомов углерода, не участвовавшие в гибридизации, перекрываются, образуя p-связь, и их
геометрия такова, что перекрывание происходит не по линии связи С - С, а выше и ниже этой линии (на данном рисунке перекрывание pz-орбиталей показано черными стрелками). Между двумя атомами углерода и четырьмя атомами водорода реализуются четыре σ-связи.
Во всех ацетиленовых углеводородах (алкинах): C2H2 (ацетилен), C4H6, C6H10 и т. д. (общая формула алкинов CnH2n-2) и других подобных органических соединениях со связями -С ≡ С- наблюдается sp-гибридизация.
При этом гибридные орбитали атомов углерода образуют две σ-связи с соседними атомами, а негибридные орбитали атомов углерода образуют две π-связи. Перекрывание орбиталей между атомами с sp-гибридными орбиталями в ацетилене С2Н2 показано на рис.4.5.
Как видно, в С2Н2 между двумя атомами С - С образуется одна σ-связь и две π-связи, сформированные за счет перекрывания pz- и pу-орбиталей. Между С и Н реализуется σ-связь.
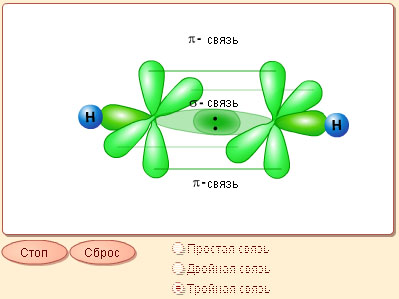
|
Рис. 4.5. Схема перекрывания АО в молекуле ацетилена
sp-гибридизации соответствует валентный угол в 1800, sp2 – 1200, sp3 – 109,5о и т.д.
В некоторых случаях в гибридизации участвуют не образующие связь валентные электронные пары центрального атома (несвязывающие электронные пары). Пространственную конфигурацию молекулы или иона и тип гибридизации определяет суммарное число связывающих и несвязывающих s-электронных пар.
В случае участия в гибридизации несвязывающих электронных пар происходит искажение правильной геометрии молекул, и валентный угол отклоняется от теоретического.
В качестве примера рассмотрим структуру sp3 гибридных молекул (CH4, NH3, H2O), образованных элементами второго периода.
Углерод 6С Азот 7N Кислород 8O
2s 2p 2s 2p 2s 2p
H ∙ ∙ ∙ ∙
С N O
H H H H ∙ ∙ H
109028 1070 1050
H ′ H H
Можно видеть, что молекула метана СН4 имеет идеальное тетраэдрическое строение с углом 109028′, в молекуле аммиака NH3 в гибридизации принимает участие двухэлектронная 2s орбиталь, которая не образует связи с атомом водорода. Валентный угол искажается до 1070. В молекуле воды Н2О таких орбиталей две, а угол искажен еще больше 1050.
У атомов третьего и больших периодов в гибридизации могут принимать участие и d-орбитали.Однако это становится возможным только в том случае, когда они характеризуются прмерно теми же размерами, что и s- и р-орбитали. В этом случае возможно образование sp3d-, sp3d2 и sp3d3 гибридных орбиталей.
Следует отметить, что гибридные молекулы с одинаковыми периферийными атомами и без участия в гибридизации несвязывающих орбиталей, являются высокосимметричными и не полярными. Дипольные моменты отдельных связей компенсируют друг друга и суммарный дипольный момент молекулы равен нулю.
Конкретный тип гибридизации орбиталей иногда трудно спрогнозировать. Представления о типе гибридизации можно использовать только в том случае, если известна геометрия молекул.
Метод ВС имеет серьезные недостатки. Так, согласно методу ВС, в образовании химической связи принимают участие валентные электроны, которые, в соответствии с принципом Паули, должны иметь противоположно направленные спины (электроны спарены), и в этом случае все молекулы должны быть диамагнитными. Метод ВС принципиально не может объяснить магнитные свойства молекул. Кроме того, с помощью метода ВС невозможно объяснить существование иона Н2+, Не2+, свободных радикалов, образование молекул из ряда d-элементов.
Этих недостатков лишен метод молекулярных орбиталей.
Дата добавления: 2021-01-26; просмотров: 696;











