Расчет приращения энтропии
Энтропия – это такая функция состояния термодинамической системы, дифференциал которой
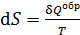 . (31)
. (31)
Здесь 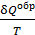 – приведенное количество теплоты, где
– приведенное количество теплоты, где 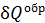 – бесконечно малое количество теплоты, сообщаемое телу при температуре T. Из формулы (31) следует, что единица измерения энтропии – 1
– бесконечно малое количество теплоты, сообщаемое телу при температуре T. Из формулы (31) следует, что единица измерения энтропии – 1 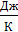 .
.
Второе начало термодинамики, как закон возрастания энтропии:
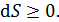
Энтропия замкнутой термодинамической системы возрастает ( 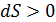 ),если в системе идут необратимые процессы, и не изменяется(
),если в системе идут необратимые процессы, и не изменяется( 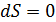 )при равновесии. Замкнутой является термодинамическая система, которая не обменивается энергией с окружающей средой, т. е. для нее
)при равновесии. Замкнутой является термодинамическая система, которая не обменивается энергией с окружающей средой, т. е. для нее 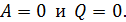
Энтропия незамкнутой системы может изменяться любым образом (убывать, возрастать, оставаться постоянной) в соответствии с формулой (31); например, если 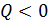 , т. е. система отдает теплоту, то и
, т. е. система отдает теплоту, то и 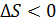 , что означает уменьшение энтропии системы, но при
, что означает уменьшение энтропии системы, но при 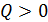 величина
величина 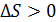 и энтропия системы возрастает.
и энтропия системы возрастает.
Энтропия является аддитивной величиной: энтропия системы равна сумме энтропий тел, входящих в систему. Например, энтропия смеси двух газов, а также ее приращение 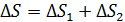 , – равно сумме приращений энтропии первого и второго компонентов смеси.
, – равно сумме приращений энтропии первого и второго компонентов смеси.
В соответствии с определительной формулой (31) для адиабатного процесса ( 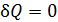 ) имеем
) имеем 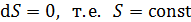 ; следовательно, обратимый адиабатный процесс протекает при постоянной энтропии. Поэтому адиабатный процесс называют изоэнтропийным.
; следовательно, обратимый адиабатный процесс протекает при постоянной энтропии. Поэтому адиабатный процесс называют изоэнтропийным.
Расчет приращения энтропии 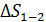 при переходе системы из состояния 1 в состояние 2 ведется путем суммирования бесконечно малых приращений
при переходе системы из состояния 1 в состояние 2 ведется путем суммирования бесконечно малых приращений 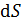 с учетом формулы (31):
с учетом формулы (31):
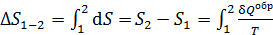 , (32)
, (32)
где величина 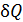 , согласно формуле (21):
, согласно формуле (21):
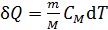 .
.
В изобарном процессе приращение энтропии
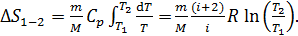 (33)
(33)
В изохорном процессе аналогично:
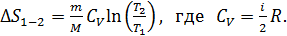 (34)
(34)
В изотермическом процессе, с учетом первого закона ТД в виде 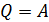 и формулы для работы, находим
и формулы для работы, находим
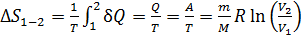 .
.
При фазовых переходах, протекающих при постоянной температуре T, в соответствии с формулой (32), получаем
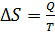 , (35)
, (35)
где 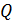 – теплота фазового перехода. Например, для плавления льда
– теплота фазового перехода. Например, для плавления льда
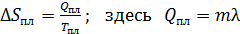 ,
,
где λ – удельная (на 1 кг массы) теплота плавления льда.
| Рис. 19 |
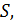
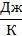
|
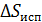
|
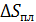
|
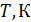
|
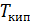
|
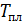
|
|
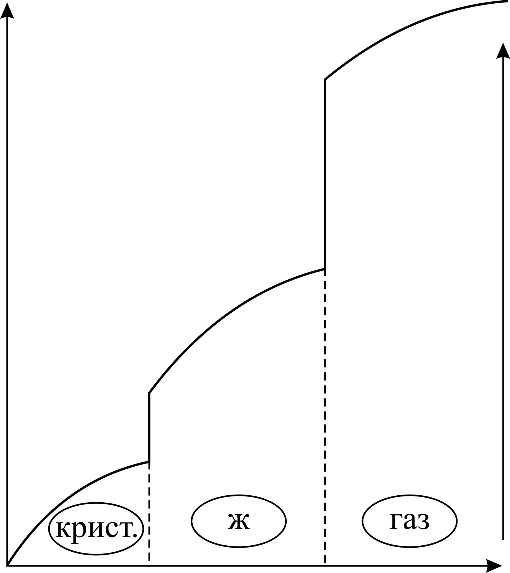 Результаты расчета по формулам (34) и (35) показаны на графике (рис. 19). График зависимости
Результаты расчета по формулам (34) и (35) показаны на графике (рис. 19). График зависимости 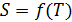 начинается практически в точке (0;0), так как третье начало термодинамики (теорема Нернста– Планка) утверждает, что энтропия всех тел стремится к нулю при приближении температуры
начинается практически в точке (0;0), так как третье начало термодинамики (теорема Нернста– Планка) утверждает, что энтропия всех тел стремится к нулю при приближении температуры 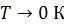 . В направлении, показанном стрелкой (справа от графика
. В направлении, показанном стрелкой (справа от графика 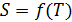 ), по мере возрастания температуры происходит увеличение энтропии вещества. При этом увеличивается объем системы и с увеличением температуры возрастает скорость движения молекул. Следовательно, растет хаотичность («беспорядок») как в расположении молекул в объеме вещества, так и в движении молекул.
), по мере возрастания температуры происходит увеличение энтропии вещества. При этом увеличивается объем системы и с увеличением температуры возрастает скорость движения молекул. Следовательно, растет хаотичность («беспорядок») как в расположении молекул в объеме вещества, так и в движении молекул.
Дата добавления: 2016-10-07; просмотров: 9551;











