Патофизиология красной крови
Заболевания красной крови связаны с абсолютным недостатком или избытком красных кровяных телец, либо с качественными изменениями последних, препятствующими выполнению их функций.
Эритроциты. Эритроциты (Эр) открыл в начале XVIII века Антонис ван Левенгук. Эти постклеточные структуры не дают возможности гемоглобину вытекать в плазму, откуда он постепенно перешел бы в мочу и в ткани. В норме свободного гемоглобина в плазме ничтожно мало (10-40 мг/л).
Данная контейнерная функция делает Эр главными переносчиками кислорода. Однако, назначение красных кровяных телец совсем не сводится к шутливой формулировке из знаменитой «Гистоазбуки» профессора Кнорре («Эритроцит совсем смешон — /Всех органоидов лишён./ Навеки быть ему судьбина/ Контейнером гемоглобина»).
За счет карбоангидразы эритроцитов осуществляется взаимодействие диоксида углерода с водой — и транспорт углекислоты. Очень велика роль ионообмена между эритроцитами и плазмой, в частности, эффекта Хамбургера — обмена катионов водорода на натрий — в поддержнии кислотно-щелочного равновесия (КЩР) и электролитного баланса организма. Огромна ёмкость гемоглобина, как буферной системы. Эритроциты — адсорбенты для иммунных комплексов, физиологически предохраняющие стенку сосудов от развития иммунокомплексных васкулитов.
Красные кровяные тельца обладают двояковогнутой формой и большой способностью к деформации, благодаря чему эффективно обеспечивают процессы диффузии газов и могут проходить через капилляры диаметром в 3-4 раза меньше самих этих кровяных элементов. Белки их цитоскелета и плазматической мембраны (ИМ), в том числе — важнейшие из них: спектрин, анкирин, аддуцин, белок 4.1, белок 3-й полосы и гликофорин — обеспечивают механические свойства и поддерживают форму эритроцита. При дефектах этих белков возникают аномалии формы эритроцитов и укорачивается срок их жизни.
Эритроцит — постклеточная структура с редуцированным, во многих отношениях, набором ферментов и рецепторов.
ПМ эритроцитов обладает лишь незначительной активностью фосфолипаз, в связи с чем при повреждении они, в отличие от других клеток, практически, не включают механизмы продукции медиаторов арахидонового каскада. Не экспрессированы на эритроцитах и антигены ГКГС, зато на них, например, имеются группоспецифические антигены системы ABО.
Несмотря на отсутствие ядра и большинства цитоплазматических органоидов, эритроциты — метаболически весьма активные клетки, обладающие спонтанной энергопродукцией на уровне 80 пикоджоулей на клетку (Левин, 1974). Энергетика эритроцитов основывается на гликолизе и реакциях пентозного цикла.
Продукция АТФ и восстановленного НАД Ф позволяет эритроцитам поддерживать и регенерировать достаточное количество антиоксидантов, включая глютатион и аскорбиновую кислоту, накапливающиеся в эритроцитах. При дефектах энергетического обмена в эритроцитах снижается резервный пул восстановленных антиоксидантов и укорачивается жизнь красных кровяных телец, подверженных аутоокислению.
Главный белок эритроцитов — гемоглобин, представляющий 98% всех протеинов красных кровяных клеток. Это сложный металлопротеид четвертичной структуры, имеющий в своём составе гем, то есть молекулу протопорфирина IX с вставленным в неё атомом двухвалентного железа, а также глобин — гетеродимерный тетрамер из четырёх полипептидных цепей. Цепи присоединены к гему через остатки пропионовой кислоты. В составе белковой части гемоглобина преобладают такие аминокислоты, как лейцин, валин и лизин, вместе дающие до 1/3 всех её мономеров (Алексеенко, 1966).
В нормальных гемоглобинах человека всегда, за исключением некоторых эмбриональных гемоглобинов — см. ниже) две цепи из четырех представлены так называемым α-типом а две другие принадлежат к другому типу (а именно — ß, γ, или δ). Высокая растворимость гемоглобина сохраняется только при наличии в составе глобинового тетрамера различных пар цепей. В случае соединения четырех одинаковых цепочек следуют быстрая денатурация и седиментация, укорачивающая жизнь Эр (см. ниже — «Гемоглобинопатии»). Поэтому синтез гемоглобина требует обращения как к 16-й хромосоме, хранящей копии генов a-цепей, так и к хромосоме 11, где кодируются остальные цепи.
Главное свойство гемоглобина — способность обратимо связывать в лёгких и эффективно отдавать в тканях кислород. На 1 г Нв связывается 1,34 мл кислорода — коэффициент Гефтнера. Каждый тетрамер Нв может связать своми четырьмя атомами железа до 4 молекул 02 Сродство гемоглобина к кислороду меньше, чем у некоторых других ферропротеинов — например, миогло- бина. Но, поистине, уникальным для этого белка является сочетание прочности связывания кислорода при высоких его парциальных напряжениях и легкости диссоциации этой связи в области низких парциальных напряжений.
Данный процесс иллюстрируется знакомой каждому студенту-медику гиперболической кривой (рис. 3). Под влиянием ацидоза и гипертермии, кривая сдвигается вправо (эффект Бора). Поэтому отдача кислорода в тканях активируется при лихорадке и гипоксии. При алкалозе, гипотермии следует обратное смещение, улучшаются условия насыщения НЬ кислородом в легких, но полнота отдачи кислорода в тканях уменьшается. Так происходит при гипервентиляции, замерзании и т.д.
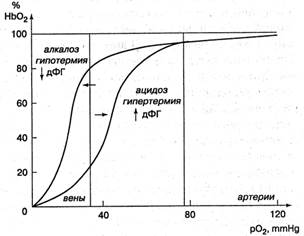
Рис. 3. Кривая диссоциации оксигемоглобина. Сокращения — Нb02 — оксигемоглобин, р02 — парциальное напряжение кислорода в крови, ДФГ— дифосфоглицерин, mmHg — мм ртутного столба (по Гайтону, 1989)
Попадая в условия острой гипоксии, эритроциты активируют гликолиз. При увеличении содержания продукта гликолиза 2,3-дифосфоглицерата (2,3-Д ФГ) в эритроцитах происходит снижение сродства НЬ к кислороду и более активная деоксигенация крови в тканях, что носит приспособительный характер. При снижении уровня дифосфоглицерата обратный эффект делает насыщение Hb кислородом в легких несколько активнее. Дифосфоглицерат, присутствующий в эритроцитах в довольно высоких концентрациях, оказывает весьма сильное влияние на сродство гемоглобина к кислороду.
Оно наблюдается и in vitro: при добавлении 2,3- ДФГ к раствору чистого Hb, сродство последнего к кислороду значительно снижается. Кислород и 2,3-ДФГ присоединяются к разным участкам молекулы Hb Молекула ДГФ присоединяется к дезокси-Нb в его центральной полости, образуя поперечную связь (солевой мостик) между двумя ß- субъединицами.
В физиологических условиях регулирующее влияние 2,3-ДФГ на сродство НЬ к кислороду определяется величиной парциального давления кислорода в легких. Так при подъеме на высоту (высокогорье) концентрация 2,3-ДФГ в эритроцитах возрастает, а сродство НЬ к кислороду снижается. У жителей гор, которые спускаются в долины, наблюдается обратный процесс.
Фетальный гемоглобин (2α2γ) с глицерофосфатом не взаимодействует, сохраняя повышенное сродство к кислороду и в артериальной, и в венозной крови.
Поскольку 99% форменных элементов крови составляют именно красные кровяные тельца, а также в связи с тем, что все они едины по происхождению и функциям — огромное значение в гематологии имеют, по выражению Подвысоцкого (1905) «расстройства из жизни красных кровяных шариков». Современная гематология рассматривает все красные клетки, как единую популяцию - эритрон, причем постулируется, что для зрелых элементов эритрона кровь — это и средство транспорта, и среда функционирования.
Дата добавления: 2023-04-21; просмотров: 1017;











