Потенциометрический метод определения рН.
В настоящее время наиболее распространен потенциометрический метод определения рН, поскольку он является наиболее точным и быстрым. Метод основан на измерении ЭДС гальванической цепи, составленной из электрода, обладающего водородной функцией, и электрода сравнения. Существует ряд электродов, обладающих водородной функцией (водородный, хингидронный, стеклянный), но в настоящее время в лабораторной практике широко применяется стеклянный электрод с водородной функцией, т.к. он обладает рядом преимуществ. Например, одним из преимуществ стеклянного электрода является то, что он позволяет определять рН раствора любого химического соединения в достаточно широком диапазоне значений.
Схематически стеклянный электрод, обладающий водородной функцией, записывается следующим образом:
Ag | AgCl, 0,1н HCl | 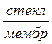 |
| 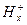 .
.
 Для измерения рН раствора составляют цепь из стеклянного и хлорсеребряного электродов. Хлорсеребряный электрод является электродом сравнения. Таким образом, стеклянно-хлорсеребряная цепь записывается так:
Для измерения рН раствора составляют цепь из стеклянного и хлорсеребряного электродов. Хлорсеребряный электрод является электродом сравнения. Таким образом, стеклянно-хлорсеребряная цепь записывается так:
Ag | AgCl, 0,1н НСl | 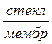 |
| 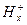
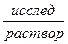 |KClнасыщ, AgCl| Ag.
|KClнасыщ, AgCl| Ag.
Величина потенциала стеклянного электрода (eст) связана с концентрацией Н+- ионов исследуемого раствора уравнением Нернста:
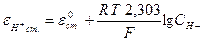 или
или
eН+ст. = e°Н+ст. + 0,0579 lgаН+
где: e0ст – потенциал асимметрии стеклянного электрода, величина переменная (в отличие от металлов) и поэтому требующая корректировки по буферным растворам.
Расчет рН растворов при использовании стеклянно-хлорсеребряной цепи потенциометрическим методом заключается в следующем. ЭДС любой гальванической цепи равна разности электродных потенциалов:
Е = eН+ст. - eхл.
подставим в данное уравнение значение электродного потенциала стеклянного электрода:
Е = e°Н+ст. + 0.0579 lgаН+ - eхл.
решим данное уравнение относительно рН:
-0.0579 lgаН+ = e°Н+ст. - eхл. – Е
а т.к. -lgаН+ = рН , то
рН = e°Н+ст. - eхл. – Е / 0,0579
Дата добавления: 2016-09-26; просмотров: 2402;











